
【题目】已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。现取该溶液进行实验,操作和现象如下。有关该溶液的判断正确的是( )
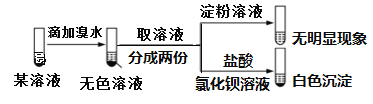
A.肯定不含I﹣B.可能不含SO42-
C.肯定含有SO32-D.肯定含有NH4+
【答案】C
【解析】
A.由于亚铁离子和铁离子均有颜色,根据实验,向该溶液中滴加溴水,得到无色溶液,一定不含Fe2+,又因为溴水为橙色,碘水为黄色,根据SO32-+I2+H2O→SO42-+2I-+2H+可知,与溴反应的只能是SO32-,若溴水少量,先氧化SO32-,则不能确定是否含I-,故A错误;
B.溶液中一定含有,SO32-,一定不含Fe2+,因为所有离子物质的量浓度相等,阳离子Na+、NH4+、K+,存在其中的两种或三种,若含有SO42-,不能满足电荷守恒,因此一定不存在SO42-,故B错误;
C.由上述分析可知,肯定含有SO32-,故C正确;
D.根据实验不能判断I-是否存在,若阴离子只有SO32-,则含有阳离子为Na+、NH4+、K+中的两种,均可满足电荷守恒,不能确定是否含NH4+,故D错误;
故选C。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
I.采样
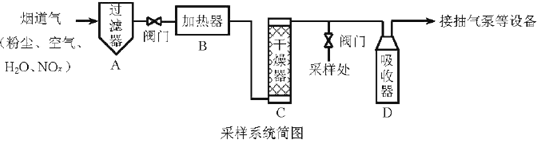
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140。C;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
II. NOx含量的测定
将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3-,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
(1)NO被H2O2氧化为NO3-的离子方程式是___________。
(2)滴定操作使用的玻璃仪器主要有___________。
(3)滴定过程中发生下列反应:
3Fe2+ +NO3-+4H+ = NO↑+3Fe3+ +2H2O
Cr2O72-+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_________mg·m-3。
(4)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果___________。若FeSO4标准溶液部分变质,会使测定结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如图:
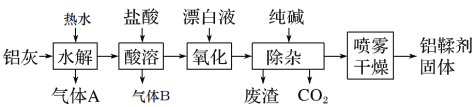
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90℃时水解生成A的化学方程式为:__,“水解”采用90℃而不在室温下进行的原因是___。
(2)“酸溶”时,生成气体B的离子方程式为___。
(3)“氧化”时反应的离子方程式为___。
(4)“除杂”中反应的离子方程式为__。
(5)“喷雾干燥”是将需干燥的物料,分散成很细的像雾一样的微粒,与热空气接触,在瞬间将大部分水分除去,使物料中的固体物质干燥成粉末。采用喷雾干燥而不用蒸发可有效防止产品的水解或分解,写出Al(OH)2Cl在较高温度下分解的化学方程式___。“喷雾干燥”中将需干燥的物料,分散成很细的微粒的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中物质间的转化能按如图所示通过一步反应进行的是( )
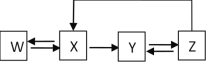
选项物质 | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中有毒气体处理为无毒气体。下图表示反应中的各种分子,其中不同的球表示不同种元素的原子。下列说法中,不正确的是 ( )
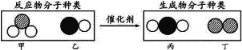
A. 乙、丙所含元素种类相同 B. 甲、丁中同种元素化合价不相等
C. 该反应中共有三种元素 D. 化学方程式中乙、丁的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常将酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并在横线及方框中填上所需的系数及微粒。
__H++__MnO4-+__H2C2O4→__CO2↑+__Mn2++__,___
(2)该反应中的还原剂是___。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的离子方程式是___。
②溶解沉淀时___(能或不能)用稀盐酸,原因是___。
③若滴定至终点时共消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则该血液中含钙___g/100mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是______________(填元素符号)。
(2)③的气态氢化物的电子式______________,②④形成的可溶于水的气态化合物的结构式______________。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为______________(填物质的化学式),酸性最强的含氧酸为______________(填物质的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14g铜银合金与足量的HNO3反应,放出的气体与标准状况下体积为1.12L的O2 混合后再通入水中,恰好全部吸收,则合金中铜的质量为
A. 4.8g B. 3.2g C. 6.4g D. 10.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验对应现象及结论有错误的是( )
选项 | 实验 | 现象 | 结论 |
A | 向AgCl悬浊液中加入KI溶液,振荡 | 沉淀由白色变为黄色 | AgCl溶解度大于AgI |
B | 向2mL0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取4mL 0.1mol/L 酸性KMnO4溶液,分别加入0.1mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2mol/L H2C2O4 溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com