
【题目】下列实验对应现象及结论有错误的是( )
选项 | 实验 | 现象 | 结论 |
A | 向AgCl悬浊液中加入KI溶液,振荡 | 沉淀由白色变为黄色 | AgCl溶解度大于AgI |
B | 向2mL0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取4mL 0.1mol/L 酸性KMnO4溶液,分别加入0.1mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2mol/L H2C2O4 溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. AB. BC. CD. D
【答案】D
【解析】
A.AgCl难溶于水,在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),向AgCl悬浊液中加入KI溶液,振荡,发现沉淀逐渐变为黄色,是由于发生了反应:Ag++I-=AgI↓,使沉淀溶解平衡正向移动,逐渐溶解转化为AgI沉淀,因此可以说明AgCl溶解度大于AgI,A正确;
Ag+(aq)+Cl-(aq),向AgCl悬浊液中加入KI溶液,振荡,发现沉淀逐渐变为黄色,是由于发生了反应:Ag++I-=AgI↓,使沉淀溶解平衡正向移动,逐渐溶解转化为AgI沉淀,因此可以说明AgCl溶解度大于AgI,A正确;
B.向2mL0.1mol/L的FeCl3溶液中加足量铁粉,振荡,发生反应:2Fe3++Fe=3Fe2+,由于没有了Fe3+,所以再滴加1滴KSCN溶液,溶液也不会出现红色,可以证明物质的还原性Fe>Fe2+,B正确;
C. CH3COONa和NaHCO3都是强碱弱酸盐,在溶液中弱酸根离子发生水解反应,消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性,根据盐的水解规律:有弱才水解,谁弱谁水解,谁强显谁性,等浓度的两种盐溶液滴加酚酞试液后NaHCO3红色更深,说明水解程度:NaHCO3>CH3COONa,水解平衡常数:Kh(CH3COO-)<Kh(HCO3-),C正确;
D.生成的Mn2+可作催化剂,不能说明浓度对化学反应的速率有影响,D错误;
故合理选项是D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。现取该溶液进行实验,操作和现象如下。有关该溶液的判断正确的是( )
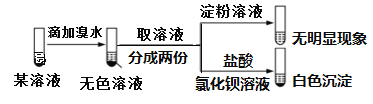
A.肯定不含I﹣B.可能不含SO42-
C.肯定含有SO32-D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 18g重水(D2O)所含的电子数目为10NA
B. Na2O2与足量的水反应生成1 molO2,转移电子数目为2NA
C. 100 mL1 molL-1 FeCl3溶液中含有 Fe3+数目为 0.1NA
D. 将2molSO2和1molO2充分反应,转移的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素在自然界有35Cl和37Cl两种同位素,氯元素的相对原子质量为35.5,则35Cl和37Cl的原子个数比为____;由Na、35Cl和37C构成的11.7g氯化钠中含35Cl的质量是___g;11.7g该晶体刚好能和某200mL的AgNO3溶液完全反应,则该AgNO3溶液的物质的量浓度是___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年诺贝尔化学奖在10月3日揭晓,弗朗西斯阿诺德、乔治史密斯和格雷戈里温特尔共同获奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。如图所示是木瓜蛋白酶(蛋白质)的结构简式,下列说法不正确的是( )
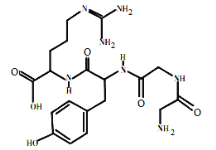
A. 醋酸铅可使木瓜蛋白酶变性
B. 木瓜蛋白酶含有苯环,属于芳香烃
C. 木瓜蛋白酶能发生水解反应、加成反应
D. 木瓜蛋白酶能与碳酸钠反应生成CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) H2(g)+CO(g),气体的总物质的量不再改变不能说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2等于Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B________________;C______________。
(2)写出D元素在周期表中的位置___________________________
(3)用电子式表示C2D的形成过程:_______________________________
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式_______;属于_______(填“离子”或“共价”)化合物,存在的化学键的种类有______________________;写出它与水反应的离子方程式_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些原子的2p能级和3d能级中电子排布的情况。其中违反了洪特规则的是( )
① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]() ⑤
⑤![]()
A. ①②B. ①②③C. ②④⑤D. ①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com