
【题目】医学上常将酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并在横线及方框中填上所需的系数及微粒。
__H++__MnO4-+__H2C2O4→__CO2↑+__Mn2++__,___
(2)该反应中的还原剂是___。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的离子方程式是___。
②溶解沉淀时___(能或不能)用稀盐酸,原因是___。
③若滴定至终点时共消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则该血液中含钙___g/100mL。
【答案】6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O H2C2O4 0.08 CaC2O4+2H+=Ca2++H2C2O4 不能 KMnO4会氧化Cl- 0.01
【解析】
(1)根据元素守恒知,生成物中还含有水,结合化合价升降守恒分析配平;
(2)氧化还原反应中还原剂失去电子元素化合价升高,据此判断;
(3)反应中Mn元素化合价由+7价变为+2价,有MnO4-~5e-,据此分析计算;
(4)①稀硫酸溶解CaC2O4沉淀发生的是复分解反应,据此书写反应的离子方程式;②HCl具有还原性,能被酸性高锰酸钾溶液氧化;③根据原子守恒得关系式5Ca2+~2KMnO4,根据消耗的高锰酸钾计算。
(1)根据元素守恒知,生成物中还含有水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据化合价升降守恒,其转移电子总数为10,所以MnO4-、H2C2O4的计量数分别是2、5,再结合原子守恒配平方程式为6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O,故答案为:6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O;
(2)反应中,还原剂失电子,元素的化合价升高,因此H2C2O4是还原剂,发生氧化反应,故答案为:H2C2O4;
(3)反应中Mn元素化合价由+7价变为+2价,有MnO4-~5e-,反应转移了0.4mol电子,则消耗KMnO4的物质的量=![]() =0.08mol;故答案为:0.08;
=0.08mol;故答案为:0.08;
(4)①稀硫酸溶解CaC2O4沉淀得到硫酸钙和草酸,反应的离子方程式为:CaC2O4+2H+=Ca2++H2C2O4,故答案为:CaC2O4+2H+=Ca2++H2C2O4;
②沉淀溶解不能用稀盐酸,因为KMnO4会氧化Cl-,故答案为:不能;KMnO4会氧化Cl-;
③根据原子守恒得5Ca2+~5(NH4)2C2O4~5CaC2O4~5H2C2O4~2KMnO4,所以得关系式5Ca2+~2KMnO4,设钙离子浓度为xmol/L,
5Ca2+~~~~~~~2KMnO4
5 2
2.0×10-3L×xmol/L 0.02L×1.0×10-4mol/L
5∶2=2.0×10-3xmol∶2.0×10-6mol
解得:x=![]() =2.5×10-3mol/L,则100mL溶液中钙的质量=40g/mol×0.1L×2.5×10-3mol/L=0.01g,故答案为:0.01。
=2.5×10-3mol/L,则100mL溶液中钙的质量=40g/mol×0.1L×2.5×10-3mol/L=0.01g,故答案为:0.01。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】毒奶粉事件曾一度震惊全国,主要是奶粉中含有有毒的三聚氰胺。下列关于三聚氰胺分子的说法中正确的是( )

A. 所有氮原子均采取sp3杂化
B. 一个三聚氰胺分子中共含有15个σ键
C. 三聚氰胺的分子式为C3N3H6
D. 三聚氰胺分子中同时含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计如下实验装置进行探究。
⑴装置A中反应的化学方程式为____________。
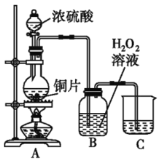
⑵实验结束后,欲验证反应生成的气体具有还原性,小组同学取装置B中溶液少量于一洁净的试管中,应向试管中加入的试剂是___。(填字母)。
a.品红溶液 b.稀盐酸 c.BaCl2溶液 d.稀硝酸
⑶实验结束,小组同学立即熄灭酒精灯,可能导致的后果是______________。
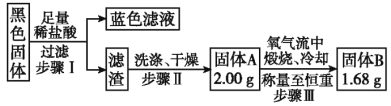
⑷实验结束,发现在铜片表面附着黑色固体。查阅资料得知此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为CuO和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:
①步骤Ⅱ中检验滤渣是否洗涤干净的实验方法是_______________。
②黑色固体的成分是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m、n、x、y四种主族元素在周期表里的相对位置如下图所示。已知它们的原子序数总和为46,则:
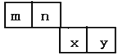
(1)元素n的气态氢化物的分子式为_____________ ,空间构型为_____________。
(2)m与y所形成的化合物含_________ 键,属_________ 分子。(填“极性”或“非极性”)
(3)x位于周期表中的位置是______;与其最高价含氧酸根离子互为等电子体的分子是_____________(写一种)。
(4)由n、y的氢化物相互作用所生成的物质在固态时属于_________晶体,y的某种含氧酸钠盐显碱性,其原因为_______________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。现取该溶液进行实验,操作和现象如下。有关该溶液的判断正确的是( )
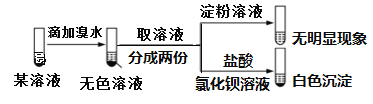
A.肯定不含I﹣B.可能不含SO42-
C.肯定含有SO32-D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚,天津塘沽滨海新区危险品仓库发生大爆炸,造成了巨大损失。 据悉,该危险品仓库存放的危险品有多种,包括剧毒化学品氰化钠(NaCN)。下列有关氰化钠的说法中错误的是()
A. NaCN 中碳元素的化合价为+4
B. NaCN易溶于水,其水溶液呈碱性
C. 可用强氧化剂如H2O2等将NaCN氧化为无毒物质
D. 为防止中毒,须加强对地表水、排海口等的氰化物排查
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是

A. 图甲表示:向某明矾液中滴加过量的NaOH溶液,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中滴加过量的稀盐酸,生成气体的体积与滴加HC1溶液体积的关系
C. 图丙表示:在稀硝酸溶液中加入过量的铁粉,溶液中Fe3+物质的量与加入铁粉物质的量的变化关系
D. 根据图丁,除去混在KNO3中少量的NaCl可用蒸发结晶的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下反应:A2(气)+B2(气)![]() 2AB(气)达平衡状态的标志是( )
2AB(气)达平衡状态的标志是( )
A.单位时间内生成n摩A2,同时生成n摩AB
B.单位时间内生成n摩B2,同时生成2n摩AB
C.单位时间内生成n摩A2,同时生成n摩B2
D.容器内总物质的量不变(或总压不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com