
����Ŀ��ij�о���ѧϰС���������ʵ��װ�ý���̽����
��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ____________��
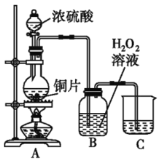
��ʵ�����������֤��Ӧ���ɵ�������л�ԭ�ԣ�С��ͬѧȡװ��B����Һ������һ�ྻ���Թ��У�Ӧ���Թ��м�����Լ���___��������ĸ����
a��Ʒ����Һ b��ϡ���� c��BaCl2��Һ d��ϡ����
��ʵ�������С��ͬѧ����Ϩ��ƾ��ƣ����ܵ��µĺ����______________��
��ʵ�������������ͭƬ���渽�ź�ɫ���塣�������ϵ�֪�˺�ɫ������ܺ���CuO��CuS��Cu2S��������CuS��Cu2S��������ϡ���ᣬ�ڿ��������ն�ת��ΪCuO��SO2����С��ͬѧ�ռ�һ������ɫ���壬������ʵ�鷽��̽����ɷ֣�
�ٲ�����м��������Ƿ�ϴ�Ӹɾ���ʵ�鷽����_______________��
�ں�ɫ����ijɷ���_______________��
���𰸡�Cu+2H2SO4![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O ![]() װ��B�е���Һ�ᵹ��������������ƿ���� ȡ���һ��ϴ����Һ�������μ�����AgNO3��Һ������������ CuO��CuS��Cu2S
װ��B�е���Һ�ᵹ��������������ƿ���� ȡ���һ��ϴ����Һ�������μ�����AgNO3��Һ������������ CuO��CuS��Cu2S
��������
��1��ͭ��Ũ���Ṳ����������ͭ�����������ˮ��
��2����Bװ���й��������Ѷ�����������Ϊ���ᣬ��Ҫ�����������ԭ�ԣ�ʵ��Ҫ����������������Ĵ��ڣ�
��3����������������ˮ��Ҫ��������
��4����������ϴ�Ӹɾ����ʵ���Ǽ������������Ƿ����������ӣ���ʵ��������������ܻ��������ӣ�������Һ��ɫ�ı仯�����պ���������ı仯�жϺ�ɫ����ijɷ֡�
��1��ͭ��Ũ���Ṳ����������ͭ�����������ˮ����Ӧ����ʽΪ��Cu+2H2SO4![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
��2����Bװ���й��������Ѷ�����������Ϊ���ᣬ��Ҫ�����������ԭ�ԣ�ʵ��Ҫ����������������Ĵ��ڣ�����ϡ������Ȼ��������飬
�ʴ�Ϊ��bc��
��3�����ڶ�������������ˮ��������Ϩ��ƾ��ƣ����ܵ��µĺ���Dz�����������
�ʴ�Ϊ��װ��B�е���Һ�ᵹ��������������ƿ���ѣ�
��4����������ϴ�Ӹɾ����ʵ���Ǽ������������Ƿ����������ӣ����ڹ����������ܽ⣬����������������ܻ��������ӣ����������������飮
�ʴ�Ϊ��ȡ���һ��ϴ����Һ�������μ�������������Һ������������
�����������ܽ����Һ������֤�������к�����ͭ������AΪͭ�����BΪCu2O��
��BȫΪCu2S��2Cu2S+3O2![]() 2Cu2O+2SO2
2Cu2O+2SO2
320 288
2g m1
���m1=1.8
��BȫΪCuS��4CuS+5O2![]() 2Cu2O+4SO2
2Cu2O+4SO2
384 288
2g m2
���m2=1.5g
��ʵ�ʵù���BΪ1.68g������m1��m2֮�䣬���Թ���AΪCu2S��CuS�Ļ���
�ʴ�Ϊ��CuO��CuS��Cu2S��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
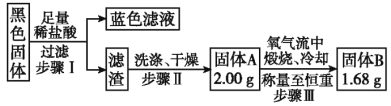
����Ŀ����ͼ��ʾΪMnO2��Ũ���Ṳ����ȡ������ʵ��װ�ã���ӦΪ��MnO2+4HCl![]() MnCl2+Cl2+2H2O����ش��������⣺
MnCl2+Cl2+2H2O����ش��������⣺

��1������K������Һ©���е�Һ�������ƿ�У��۲�D�е��ܿ��Ƿ������ݲ�����__����ܻ��ܣ���֤װ�õ����������ã�
��2��C���ռ�����Cl2�к���HCl����ӷ��ӽṹ�ĽǶȽ������е�ԭ��___��
��3��װ��D��������___��
��4��B������Ϊ___��ѡ�����б�ţ���
A.ϴ��ƿ B.����ƿ C.��ȫƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������1:3������Ȼ����һ�Թ��У�������ʢ�б���ʳ��ˮ��ˮ�ۣ����ڹ���������ͼ��ʾ���������йش�ʵ�������ͽ��۵���������ȷ���ǣ� ��
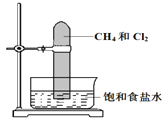
A. �Թ�������Ļ���ɫ��dz��ˮ������
B. ������ֻ�����ȼ�����Ȼ����ڱ�״����������
C. �Թ��ڱ�����״Һ���γ�
D. �Թ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ���Ʊ�ϩ���ij��÷�����ʵ�����Ʊ�����ϩ�ķ�Ӧ��ʵ��װ����ͼ��ʾ�������õ����й��������£�

��Է������� | �ܶ�/��gcm��3�� | �е�/�� | �ܽ��� | |
���Ҵ� | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᣮb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森��Ӧ�ֲ��ﵹ��f�����зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ���ش��������⣺
��1���ɻ�������ȡ����ϩ�ķ���ʽ_________________��
��2��װ��b������ˮ������________________�������½��ϳ��������Ͻ��³�������
��3���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������___��ѡ�𰸣���
A���������� B����ȴ�� C�����貹�� D����������
��4����ʵ���������ײ����ĸ����������Ĺ��������Ƽ���Ӧ����Ϊ_____��____��
��5���ڷ����ᴿ�У�ʹ�õ�������f������___________��
��6���ϳɹ����м���Ũ�����������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(��Ҫ�ɷ�ΪAl��Al2O3��AlN��FeO��)�Ʊ�������[��Ҫ�ɷ�ΪAl(OH)2Cl]��һ�ֹ�����ͼ��
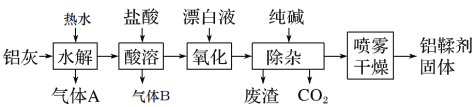
��1������A��ʹʪ��ĺ�ɫʯ����ֽ������������90��ʱˮ������A�Ļ�ѧ����ʽΪ��__����ˮ��������90������������½��е�ԭ����___��
��2����������ʱ����������B�����ӷ���ʽΪ___��
��3����������ʱ��Ӧ�����ӷ���ʽΪ___��
��4�����������з�Ӧ�����ӷ���ʽΪ__��
��5���������������ǽ����������ϣ���ɢ�ɺ�ϸ������һ�����������ȿ����Ӵ�����˲�佫��ˮ�ֳ�ȥ��ʹ�����еĹ������ʸ���ɷ�ĩ���������������������������Ч��ֹ��Ʒ��ˮ���ֽ⣬д��Al(OH)2Cl�ڽϸ��¶��·ֽ�Ļ�ѧ����ʽ___���������������н����������ϣ���ɢ�ɺ�ϸ������Ŀ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������1 mol HNO3��1 mol NaHSO4�Ļ����Һ��������������������Һ�н���������a��b���������۵����ʵ����Ĺ�ϵ��ͼ��ʾ(��֪ϡ����Ļ�ԭ����ֻ��NO)�������й��ж�����ȷ���ǣ� ��
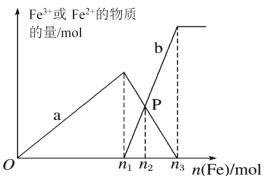
A.a��ʾFe3���Ĺ�ϵ���ߣ�b��ʾFe2+�Ĺ�ϵ����
B.n1��0.5
C.P��ʱ��n(Fe2��)��0.3mol
D.��P����Һ�м���ͭ�ۣ������ܽ�14.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʼ��ת���ܰ���ͼ��ʾͨ��һ����Ӧ���е��ǣ� ��
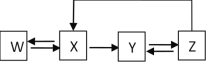
ѡ������ | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽѧ�ϳ������Ը��������Һ�Ͳ�����Һ�ķ�Ӧ���ڲⶨѪ�Ƶĺ������ش��������⣺
(1)��ƽ�������ӷ���ʽ�����ں������������������ϵ��������
__H++__MnO4-+__H2C2O4��__CO2��+__Mn2++__��___
(2)�÷�Ӧ�еĻ�ԭ����___��
(3)��Ӧת����0.4mol���ӣ�������KMnO4�����ʵ���Ϊ___mol��
(4)�ⶨѪ�Ƶĺ����ķ����ǣ�ȡ2mLѪҺ������ˮϡ�ͺ������м�������(NH4)2C2O4��Һ����Ӧ����CaC2O4��������������ϡ�����ܽ�õ�H2C2O4������KMnO4��Һ�ζ���
��ϡ�����ܽ�CaC2O4���������ӷ���ʽ��___��
���ܽ����ʱ___(�ܻ���)��ϡ���ᣬԭ����___��
�����ζ����յ�ʱ��������1.0��10-4mol/L��KMnO4��Һ20.00mL�����ѪҺ�к���___g/100mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ��������Һ�м�������İ�ˮ��A13++4NH3H2O=A1O2-+4NH4+
B. ϡ�����м���������ۣ�Fe+4H++NO3-=Fe3++NO��+2H2O
C. Ũ������������̻�ϼ��ȣ�MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
D. ʯ��ˮ�м������С�մ���Һ��HCO3-+Ca2++OH-=CaCO3��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com