
【题目】浓硫酸有许多重要的性质,工业上可以通过硫铁矿(主要成分是FeS2)制取。
(1)硫原子核外电子占有______种能量不同的轨道。H2SO4属于______晶体。
(2)非金属性:S____O(选填“>”、“<”或“=”)。试用一个实验事实说明___________________。
(3)接触法制硫酸工业中,其主要反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)![]() 2SO3(g)+190kJ该反应的平衡常数表达式是K=_____________,该反应450℃时的平衡常数______500℃时的平衡常数(选填“大于”、“小于”或“等于”)。
2SO3(g)+190kJ该反应的平衡常数表达式是K=_____________,该反应450℃时的平衡常数______500℃时的平衡常数(选填“大于”、“小于”或“等于”)。
(4)在一个固定容积为10L的密闭容器中充入0.40mol SO2和0.20 O2,半分钟后达到平衡,测得容器中含SO3 0.36mol,则v(SO2)=____mol·![]() ·min
·min![]() ;若继续通入0.40mol SO2和0.20mol O2,则平衡______移动(选填“向正反应方向”、“向逆反应反向”或“不”)。
;若继续通入0.40mol SO2和0.20mol O2,则平衡______移动(选填“向正反应方向”、“向逆反应反向”或“不”)。
(5)该热化学方程式的意义是______________________________________________。
【答案】5 分子 < 硫化氢水溶液露置于空气中变浑浊等 ![]() 大于 0.072 向正反应方向 450℃时,2mol气态SO2与1mol气态O2完成反应生成2mol气态SO3时,放出190kJ热量
大于 0.072 向正反应方向 450℃时,2mol气态SO2与1mol气态O2完成反应生成2mol气态SO3时,放出190kJ热量
【解析】
(1)基态硫原子的电子排布式为1s22s22p63s23p4,每个能级能量不同,因此硫原子核外电子占有5种能量不同的轨道;H2SO4属于分子晶体;
(2)同主族从上到下非金属性减弱,即S的非金属性弱于O,向氢硫酸溶液通入O2,溶液变浑浊,发生2H2S+O2=2S↓+2H2O,说明S的非金属性弱于O,或者硫单质在氧气中燃烧,发生S+O2=SO2,S为还原剂,O2为氧化剂,说明S的非金属性弱于O;
(3)根据平衡常数的定义,该反应平衡常数K=![]() ;化学平衡常数只受温度的影响,该反应的正反应方向是放热反应,升高温度,平衡逆向进行,化学平衡常数减小,即450℃时的平衡常数大于500℃时的平衡常数;
;化学平衡常数只受温度的影响,该反应的正反应方向是放热反应,升高温度,平衡逆向进行,化学平衡常数减小,即450℃时的平衡常数大于500℃时的平衡常数;
(4)生成SO3的物质的量为0.36mol,根据化学反应速率的数学表达式,v(SO3)=![]() =0.072mol/(L·min),根据化学反应速率之比等于化学计量数之比,v(SO2)=v(SO3)=0.072mol/(L·min);恒容状态下,再充入0.40molSO2和0.20molO2,增加反应物浓度,平衡向正反应方向移动;
=0.072mol/(L·min),根据化学反应速率之比等于化学计量数之比,v(SO2)=v(SO3)=0.072mol/(L·min);恒容状态下,再充入0.40molSO2和0.20molO2,增加反应物浓度,平衡向正反应方向移动;
(5)热化学反应方程式的意义是450℃时,2mol气态SO2与1mol气态O2完成反应生成2mol气态SO3时,放出190kJ热量。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
A. 当其他条件不变的情况下,升高温度,原有的平衡被破坏,逆反应速率增大,正反应速率减小
B. 一定存在2v(H2)正=3 v(N2)逆
C. 反应过程中可能放出92.4 kJ的热量
D. 容器内混合气体的平均相对分子质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以研究分子中只含有一个碳原子的化合物(如CO、CO2、CH3OH等)为原料合成一系列化工产品的化学。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJ·mol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)![]() CH3OH(g)的ΔH=_____ kJ·mol-1。
CH3OH(g)的ΔH=_____ kJ·mol-1。
(2)向2L恒容密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图________。

(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:
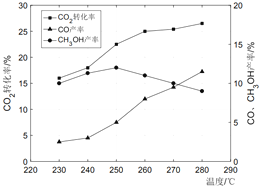
①由图可知温度升高CO产率上升,其主要原因是_____。
②由图可知获取甲醇最适宜的温度是_____。
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0L,若CO2初始加入量为2.0mol,则反应I的平衡常数是_____。
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O
2(CH3O)2CO+2H2O
(5)由图可知B极为电源_____(填“正”或“负”)极,阳极电极反应式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH= 。
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:

① 用H2 表示前2 h平均反应速率v(H2)= 。
② 该温度下CO2的平衡转化率为 。
(3)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() CH4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
CH4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:

①该反应的ΔH 0(填“>”、“=”或“<”)。
②曲线c表示的物质为 。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是 ,用平衡移动原理说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某容积一定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2)
C. 1 mol H—H键断裂的同时断裂2 mol H—O键
D. 生成n mol CO的同时消耗n mol H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度和压强相同时,在体积相同的两个密闭容器甲和乙,甲中充满O2气体,乙中充满O2和O3的混合气体,下列说法正确的是
A. 两容器中气体的质量相等 B. 两容器中气体的分子数目相等
C. 两容器中气体的氧原子数目相等 D. 两容器中气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作人体补血剂。某同学欲测定补血剂中铁元素的含量,设计了如下实验步骤:

请回答下列问题:
(1)步骤②加入过量H2O2的目的是______________________________。
(2)步骤③加入了足量氨水,反应的离子方程式为__________________________。
(3)步骤④中一系列处理的操作步骤:过滤、________、干燥、灼烧、冷却、称量。
(4)若实验中铁无损耗,则每片补血剂中含铁元素的质量为__________g。
(5)另一位同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定,反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、玻璃棒、量筒、烧杯、胶头滴管外,还需____________________。
②上述实验中的KMnO4溶液需要进行酸化处理,可用于酸化的酸的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
A.反应在前t1s 的平均速率v(O2) = 0.4/t1mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com