
【题目】原子序数依次增大的X、Y、Z、W、M五种短周期主族元素中,X、Y两元素间能形成原子个数比分别为1:1和1:2的固态化合物A和B,Y是短周期元素中失电子能力最强的元素,W、M的最高价氧化 物对应的水化物化学式分别为H3WO4、HMO4,Z的单质能与盐酸反应。
(1)根据上述条件不能确定的元素是______(填代号),A的电子式为_____,举例说明Y、Z的金属性相对强弱:______(写出一个即可)。
(2)W能形成多种含氧酸及应的盐,其中NaH2WO2能与盐酸反应但不能与NaOH溶液反应,则下列说法中正确的是___________(填字母)
A H3WO2是三元酸
B H3WO2是一元弱酸
C NaH2WO2是酸式盐
D NaH2WO2不可能被硝酸氧化
(3)X、M形成的一种化合物MX2是一种优良的水处理剂,某自来水化验室利用下列方法裣测处理后的 水中MX2残留量是否符合饮用水标准(残留MX2的浓度不高于0.1 mgL-1),已知不同pH环境中含M粒子的种类如图所示:

I.向100.00 mL水样中加入足量的KI,充分反应后将溶液调至中性,再加入2滴淀粉溶液。
向I中所得溶液中滴加2.0×10-4 molL-1的溶液至终点时消耗5.00 mL标准溶液 (已知 2S2O32- +I2 =S4O26- +2I-)。
①则该水样中残留的的浓度为______mgL-1。
②若再向II中所得溶液中加硫酸调节水样pH至13,溶液又会呈蓝色,其原因是____(用离子方程式表示)。
【答案】Z ![]() 钠的金属性比Z的强,如钠能与冷水剧烈反应而Z不能(或最高价氧化物对应水化物的碱性:Na>Z) B 0.675 ClO2-+4I-+4H+ = Cl- +2I2+2H2O
钠的金属性比Z的强,如钠能与冷水剧烈反应而Z不能(或最高价氧化物对应水化物的碱性:Na>Z) B 0.675 ClO2-+4I-+4H+ = Cl- +2I2+2H2O
【解析】
Y是短周期元素中失电子能力最强的元素,则推出Y为Na元素,又X、Y两元素间能形成原子个数比分别为1:1和1:2的固态化合物A和B,则推出X为O元素,两者形成的化合物为B为Na2O、A为Na2O2;Z的单质能与盐酸反应,则说明Z为活泼金属,为Mg或Al中的一种;W、M的最高价氧化物对应的水化物化学式分别为H3WO4、HMO4,则W和M的最高价化合价分别为+5和+7,又X、Y、Z、W、M五种短周期主族元素原子序数依次增大,则可推出W为P元素,M为Cl元素,据此分析作答。
根据上述分析易知:X、Y、Z、W、M分别是O、Na、Mg或Al、P、Cl,则
(1)Z可与盐酸反应,Z可能是Mg或Al中的一种,不能确定具体是哪一种元素;A为Na2O2,由离子键和共价键构成,其电子式为:![]() ;钠的金属性比Z的强,如钠能与冷水剧烈反应而Z不能(或最高价氧化物对应水化物的碱性:Na>Z),故答案为:Z;
;钠的金属性比Z的强,如钠能与冷水剧烈反应而Z不能(或最高价氧化物对应水化物的碱性:Na>Z),故答案为:Z;![]() ;钠的金属性比Z的强,如钠能与冷水剧烈反应而Z不能(或最高价氧化物对应水化物的碱性:Na>Z);
;钠的金属性比Z的强,如钠能与冷水剧烈反应而Z不能(或最高价氧化物对应水化物的碱性:Na>Z);
(2)NaH2PO2能与盐酸反应,说明H3PO2是弱酸,NaH2PO2不能与NaOH反应,说明NaH2PO2中的H不能被中和,推出NaH2PO2为正盐,C项错误;H3PO2分子中只能电离出一个H+,为一元弱酸,B项正确,A项错误;NaH2PO2中P的化合价为+1,具有还原性,可被硝酸氧化,D项错误;故答案为B;
(3)①由图知,中性条件下ClO2被I-还原为ClO2-,I-被氧化为I2;根据氧化还原反应中得失电子数目相等可知:2ClO2~I2~2Na2S2O3,因此可知,水中残留的ClO2的浓度为2×10-4mol/L×5×10-3L×67.5g/mol×1000mg/g÷0.1L=0.675 mg/L,故答案为:0.675;
②由图知,水样pH调至1~3时,ClO2-被还原成Cl-,该操作中I-被ClO2-氧化为I2,故离子方程式为:ClO2-+4I-+4H+ = Cl- +2I2+2H2O。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】依据要求填空:
(1)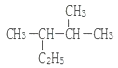 用系统命名法命名:______________;
用系统命名法命名:______________;
(2)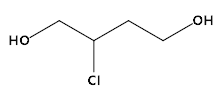 的分子式______________;
的分子式______________;
(3) ![]() 官能团的名称是________________。
官能团的名称是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是4种粒子的结构示意图:
A.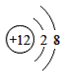 B.
B.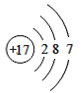 C.
C.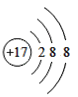 D.
D.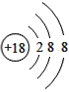
图中粒子共能表示______种元素,图中表示的阳离子是_______(用离子符号表示),图中C所表示的元素在元素周期表中的位置______。
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
C | D | ||||||||
A | B | E | F |
①D单质的电子式为:______;
②F的最高价氧化物对应水化物的化学式为:______;
③E和F分别形成的气态氢化物中稳定性较弱是______;(填写氢化物的化学式)
④A最高价氧化物的水化物所含化学键为_______,其水溶液与B的最高价氧化物的水化物反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分。 X 原子最外层电子数是其内层电子数的3倍。下列说法正确的是

A. TX2、T2 或X3均可用于做杀菌消毒
B. W元素的单质溶于水和汽化都只破坏了分子间作用力
C. 元素T 的非金属性比W强,所以HT的酸性比HW的酸性强
D. YT3在常压、 178℃时升华,所以 YT3 中只含有离子键,而 ZT4中只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色固体,熔点为390℃,沸点为430 ℃,溶于冷水,遇热水强烈水解,主要用于有机合成和药物制造。实验室制备少量氨基锂的装置如图所示(部分夹持装置已略):
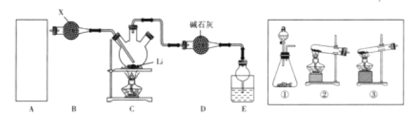
(1)A中装置是用于制备氨气的,若制备氨气的试剂之一是熟石灰,则A中制气装置是______(从方框中选用,填序号);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为_______。
(2)试剂X是_________,装置D的作用是_______。
(3)实验中需要先向C通入一段时间的NH3再点燃C处酒精灯,这样做的目的是____,可根据E中____(填现象)开始给锂加热。
(4)某同学经理论分析认为LiNH2遇热水时可生成一种气体,试设计一种方案检验该气体:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为100的有机物A能与钠反应,且完全燃烧只生成CO2和H2O。若A含一个六碳环,则环上一氯代物的数目为( )
A. 5B. 4C. 3D. 2
查看答案和解析>>
科目:高中化学 来源: 题型:
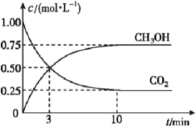
【题目】目前工业上有一种方法是用生产燃料甲醇。一定条件下发生反应,如图表示该反应过程中能量(单位kJ)的变化。
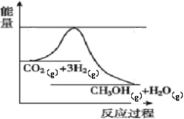
(1)已知拆开或形成![]() 化学键所吸收或放出的能量叫做该化学键的键能,单位
化学键所吸收或放出的能量叫做该化学键的键能,单位![]() 。根据表中的键能表示出图中的反应生成
。根据表中的键能表示出图中的反应生成![]() 时____________________(填“吸收”或“放出”)_____________________kJ热量。
时____________________(填“吸收”或“放出”)_____________________kJ热量。
化学键 |
|
|
|
|
|
键能( | a | b | c | d | e |
(2)在一固定容积的恒温密闭容器内进行上述反应,下列能说明该反应已经达到平衡状态的是_________(填序号)。
A ![]()
B 容器内气体压强保持不变
C ![]() 、
、![]() 、
、![]() 、
、![]() 四种气体物质的量浓度之比等于
四种气体物质的量浓度之比等于![]()
D 容器内气体密度保持不变
E ![]() 键断裂的同时
键断裂的同时![]() 键断裂
键断裂
(3)在体积为![]() 的密闭容器中,充入
的密闭容器中,充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率![]() ____________________。容器内平衡时与起始时的压强之比为____________________。
____________________。容器内平衡时与起始时的压强之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体NH4NO3受热分解的产物较复杂,分解时发生的反应遵循守恒,从得失电子守恒和元素守恒方面分析,对NH4NO3热分解的产物猜想不正确的是( )
A.N2、HNO3、H2OB.N2O、H2O
C.NO2、N2O、H2OD.NH3、HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com