
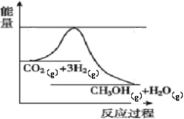
【题目】目前工业上有一种方法是用生产燃料甲醇。一定条件下发生反应,如图表示该反应过程中能量(单位kJ)的变化。
(1)已知拆开或形成![]() 化学键所吸收或放出的能量叫做该化学键的键能,单位
化学键所吸收或放出的能量叫做该化学键的键能,单位![]() 。根据表中的键能表示出图中的反应生成
。根据表中的键能表示出图中的反应生成![]() 时____________________(填“吸收”或“放出”)_____________________kJ热量。
时____________________(填“吸收”或“放出”)_____________________kJ热量。
化学键 |
|
|
|
|
|
键能( | a | b | c | d | e |
(2)在一固定容积的恒温密闭容器内进行上述反应,下列能说明该反应已经达到平衡状态的是_________(填序号)。
A ![]()
B 容器内气体压强保持不变
C ![]() 、
、![]() 、
、![]() 、
、![]() 四种气体物质的量浓度之比等于
四种气体物质的量浓度之比等于![]()
D 容器内气体密度保持不变
E ![]() 键断裂的同时
键断裂的同时![]() 键断裂
键断裂
(3)在体积为![]() 的密闭容器中,充入
的密闭容器中,充入![]() 和
和![]() ,测得
,测得![]() 和
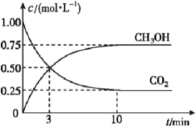
和![]() 的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率![]() ____________________。容器内平衡时与起始时的压强之比为____________________。
____________________。容器内平衡时与起始时的压强之比为____________________。
【答案】放出 2(-2a-3b+3c+d+2e) BE ![]() 5:8
5:8
【解析】
反应热等于反应物的键能总和与生成物的键能总和之差。根据化学平衡状态的特征判断可逆反应是否达到化学平衡状态。根据阿伏加德定律可知,在同温同体积条件下,气体的压强之比等于其物质的量之比。
(1)由图中信息可知,发生的反应为CO2(g)+3H2(g)=CH3OH(g)+H2O(g),该反应的反应物的总能量高于生成物的。根据表中的键能数据可以求出该反应的H=(2a+3b-3c-d-2e)![]() = -(-2a-3b+3c+d+2e)
= -(-2a-3b+3c+d+2e)![]() ,因此,生成
,因此,生成![]() 时放出2(-2a-3b+3c+d+2e)kJ热量。
时放出2(-2a-3b+3c+d+2e)kJ热量。
(2)A.![]() 说明正反应速率不等于逆反应速率,说明该反应未达平衡;
说明正反应速率不等于逆反应速率,说明该反应未达平衡;
B.反应前后的气体的分子数不同,故在反应过程中容器内的压强会发生变化,当容器内气体压强保持不变时,表明各组分的浓度保持不变,可以说明反应达到平衡状态;
C. ![]() 、
、![]() 、
、![]() 、
、![]() 四种气体物质的量浓度之比等于
四种气体物质的量浓度之比等于![]() ,不能说明其浓度之比保持这个比值不变,即不能说明各组分的浓度保持不变,不能说明达到平衡状态;
,不能说明其浓度之比保持这个比值不变,即不能说明各组分的浓度保持不变,不能说明达到平衡状态;
D. 反应过程中气体的总体积不变,气体的总质量也不变,故容器内气体密度始终保持不变,因此,容器内气体密度保持不变不能说明反应达到平衡状态;
E. ![]() 键断裂的同时
键断裂的同时![]() 键断裂可以说明正反应速率等于逆反应速率,反应达到平衡状态。
键断裂可以说明正反应速率等于逆反应速率,反应达到平衡状态。
综上所述,能说明该反应已经达到平衡状态的是BE。
(3)在体积为![]() 的密闭容器中,充入
的密闭容器中,充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率![]() 3v(CO2)=3
3v(CO2)=3![]() 。容器内平衡时与起始时的压强之比等于气体的总物质的量之比,起始时气体的总物质的量4mol,平衡时气体的总物质的量为(0.25+0.253+0.752)mol=2.5mol,所以,容器内平衡时与起始时的压强之比为2.5:4=5:8。
。容器内平衡时与起始时的压强之比等于气体的总物质的量之比,起始时气体的总物质的量4mol,平衡时气体的总物质的量为(0.25+0.253+0.752)mol=2.5mol,所以,容器内平衡时与起始时的压强之比为2.5:4=5:8。


科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.12gNaHSO4晶体中SO42-数目为0.1NA
B.2.0gD2O中含有的中子数为NA
C.2.24LCl2与足量Na2SO3溶液反应时转移的电子数为0.2NA
D.标准状况下,4.48 LHF所含原子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、W、M五种短周期主族元素中,X、Y两元素间能形成原子个数比分别为1:1和1:2的固态化合物A和B,Y是短周期元素中失电子能力最强的元素,W、M的最高价氧化 物对应的水化物化学式分别为H3WO4、HMO4,Z的单质能与盐酸反应。
(1)根据上述条件不能确定的元素是______(填代号),A的电子式为_____,举例说明Y、Z的金属性相对强弱:______(写出一个即可)。
(2)W能形成多种含氧酸及应的盐,其中NaH2WO2能与盐酸反应但不能与NaOH溶液反应,则下列说法中正确的是___________(填字母)
A H3WO2是三元酸
B H3WO2是一元弱酸
C NaH2WO2是酸式盐
D NaH2WO2不可能被硝酸氧化
(3)X、M形成的一种化合物MX2是一种优良的水处理剂,某自来水化验室利用下列方法裣测处理后的 水中MX2残留量是否符合饮用水标准(残留MX2的浓度不高于0.1 mgL-1),已知不同pH环境中含M粒子的种类如图所示:

I.向100.00 mL水样中加入足量的KI,充分反应后将溶液调至中性,再加入2滴淀粉溶液。
向I中所得溶液中滴加2.0×10-4 molL-1的溶液至终点时消耗5.00 mL标准溶液 (已知 2S2O32- +I2 =S4O26- +2I-)。
①则该水样中残留的的浓度为______mgL-1。
②若再向II中所得溶液中加硫酸调节水样pH至13,溶液又会呈蓝色,其原因是____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为![]() ,含少量
,含少量![]() 和
和![]() 等杂质)为原料生产铝和氮化铝的一种工艺流程如图[已知:
等杂质)为原料生产铝和氮化铝的一种工艺流程如图[已知:![]() 在“碱溶”时转化为铝硅酸钠(
在“碱溶”时转化为铝硅酸钠(![]() )沉淀]。
)沉淀]。
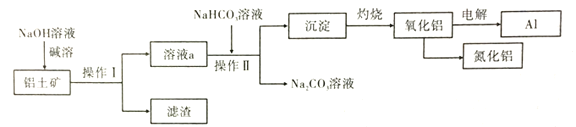
(1)用氧化物的形式表示铝硅酸钠的化学式____。
(2)溶液a中加入![]() 后,生成沉淀的离子方程式为___。
后,生成沉淀的离子方程式为___。
(3)有人考虑用熔融态![]() 电解制备铝,你觉得是否可行?请说明理由:___。
电解制备铝,你觉得是否可行?请说明理由:___。
(4)取一定量的氮化铝样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。打开![]() ,加入NaOH浓溶液,至不再产生
,加入NaOH浓溶液,至不再产生![]() 。打开
。打开![]() ,通入
,通入![]() 一段时间。
一段时间。
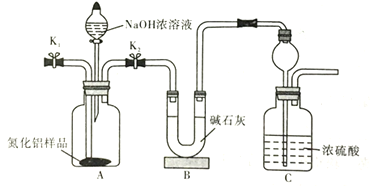
①写出AlN与NaOH溶液反应的化学方程式______。
②实验中需要测定的数据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是

A. 合理处理易拉罐有利于环境保护和资源再利用
B. 从易拉罐中可回收的金属元素有Al、Fe
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.1 mol H2 的体积是 22.4 L
B.O2 的摩尔质量是 48 g
C.标准状况下,22.4 L H2O 含有 6.02×1023 个 H2O
D.常温常压下,28g N2 与标准状况下 22.4 L CO2 含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。下列说法错误的是
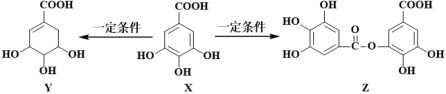
A. 1molX最多能与2mol Br2发生取代反应 B. Y分子结构中有3个手性碳原子
C. Y能发生加成、取代、消去、氧化、缩聚反应 D. 1mol Z最多能与7mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:
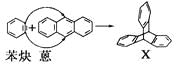
(1)蒽与X都属于________(填选项,下同)。
A.环烃 B.烷烃 C.芳香烃
(2)苯炔的分子式为________,苯炔不具有的性质是________。
A.能溶于水 B.能发生氧化反应
C.能发生加成反应 D.常温常压下为气体
(3)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列 事实。
A.苯不能使溴水褪色 B.苯能与H2发生加成反应
C.溴苯没有同分异构体 D.邻二溴苯只有一种
现代化学认为苯分子碳碳之间的键是 。
(4)下列属于苯的同系物的是________。
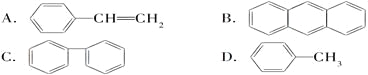
(5)能发生加成反应,也能发生取代反应,同时能使溴水因反应而褪色,也能使酸性高锰酸钾溶液褪色的是________。
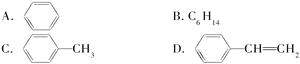
它是生产某塑料的单体,写出合成该塑料的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com