
【题目】下列说法中正确的是
A.1 mol H2 的体积是 22.4 L
B.O2 的摩尔质量是 48 g
C.标准状况下,22.4 L H2O 含有 6.02×1023 个 H2O
D.常温常压下,28g N2 与标准状况下 22.4 L CO2 含有相同的分子数
科目:高中化学 来源: 题型:
【题目】下列实验“实验操作”与“结论”对应关系正确的是
选项 | 实验操作 | 结论 |
A | 向Fe(NO3)2溶液的试管中加入稀H2SO4 ,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
B | 向沸水中逐滴加入1~2 mL FeCl3饱和溶液,煮沸至红褐色液体 | 制备Fe(OH)3胶体 |
C | 常温下,向饱和 | 说明常温下 |
D | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)

(1)B的官能团名称___。苯酚与浓溴水反应生成白色沉淀,可用于苯酚的定性检验和定量测定,反应的化学方程式为____。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C分子中有3种不同化学环境的氢原子,则M的结构简式为___。
(3)生成N的反应的化学方程式___,反应类型为_____。
(4)以苯酚为基础原料也可以合成防腐剂F.已知F的相对分子质量为152,其中氧元素的质量分数为31.58%,F完全燃烧只生成CO2和H2O2。则F的分子式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用生产燃料甲醇。一定条件下发生反应,如图表示该反应过程中能量(单位kJ)的变化。
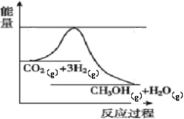
(1)已知拆开或形成![]() 化学键所吸收或放出的能量叫做该化学键的键能,单位
化学键所吸收或放出的能量叫做该化学键的键能,单位![]() 。根据表中的键能表示出图中的反应生成
。根据表中的键能表示出图中的反应生成![]() 时____________________(填“吸收”或“放出”)_____________________kJ热量。
时____________________(填“吸收”或“放出”)_____________________kJ热量。
化学键 |
|
|
|
|
|
键能( | a | b | c | d | e |
(2)在一固定容积的恒温密闭容器内进行上述反应,下列能说明该反应已经达到平衡状态的是_________(填序号)。
A ![]()
B 容器内气体压强保持不变
C ![]() 、
、![]() 、
、![]() 、
、![]() 四种气体物质的量浓度之比等于
四种气体物质的量浓度之比等于![]()
D 容器内气体密度保持不变
E ![]() 键断裂的同时
键断裂的同时![]() 键断裂
键断裂
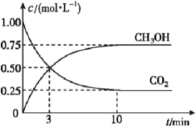
(3)在体积为![]() 的密闭容器中,充入
的密闭容器中,充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率![]() ____________________。容器内平衡时与起始时的压强之比为____________________。
____________________。容器内平衡时与起始时的压强之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种易溶于水的物质,分别由 Ba2+、Mg2+、H+、OH-、Cl-、SO![]() 、 NH
、 NH![]() 、HCO
、HCO![]() 中不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其他三种 物质的溶液混合均有白色沉淀生成;②0.1 mol·L-1 乙溶液中 c(H+)=0.2 mol·L-1;③向丙溶液中滴入 AgNO3 溶液有不溶于稀硝酸的白色沉淀生成。下列结论不正确的是
中不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其他三种 物质的溶液混合均有白色沉淀生成;②0.1 mol·L-1 乙溶液中 c(H+)=0.2 mol·L-1;③向丙溶液中滴入 AgNO3 溶液有不溶于稀硝酸的白色沉淀生成。下列结论不正确的是
A.甲溶液中含有 Ba2+B.乙溶液中含有 SO![]()
C.丙溶液中含有 Cl-D.丁溶液中含有 Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 4.6g的Na放入足量的水中,至充分完全反应。 请写出计算过程:
(1)写出化学方程式,画出双线桥。_____________________
(2)该反应电子转移的物质的量。________________________
(3)生成的 H2 在标准状况下的体积。_____________________
(4)反应后溶液体积为2L,计算所得溶液的物质的量浓度。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学在配制100mL0.1mol/L的NaOH溶液时,实验操作如下:
①往盛有NaOH固体的小烧杯中,加适量蒸馏水溶解。为加速溶解,可用_________(填仪器名称)搅拌。
②将①所得溶液冷却到室温后,小心转入___________(填仪器名称)中。
③计算需要NaOH固体的质量___________
④继续加蒸馏水至液面距刻度线1—2cm处,改用_____(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤称量NaOH的质量,在托盘天平上,先称量一干燥而洁净的烧杯的质量。然后将NaOH放入烧杯,再称出它们的总质量。从总质量减去烧杯的质量便等于所需的NaOH的质量。
⑥用少量蒸馏水洗涤烧杯内壁和玻璃棒2—3次,洗涤液也都注入容量瓶,并轻轻摇匀。
⑦将容量瓶瓶塞塞紧,反复上下颠倒,摇匀。
请回答:
(1)正确的实验操作顺序为_________________(填序号)。
(2)取出20mL配制好的溶液,此溶液中NaOH的物质的量浓度为______。
(3)下列操作会使所配溶液物质的量浓度偏高的是______(填序号)。
A.容量瓶洗净后未经干燥处理
B.向容量瓶转移溶液时,有少量液体溅出
C.在烧杯内溶解NaOH后未等冷却就立即转移到容量瓶中
D.定容时俯视刻度线
E.定容时仰视刻度线
F.倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W、X、Y三种简单离子的核外电子排布相同。下列说法错误的是
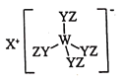
A.原子半径:![]()
B.简单离子的氧化性:![]()
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com