
【题目】下列溶液中粒子的物质的量浓度关系正确的是
A. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32 -)>c(HCO3- )>c(OH-)
B. CH3COOH溶液加水稀释,溶液中![]() 不变
不变
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D. 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
【答案】B
【解析】0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合生成碳酸钠溶液,所得溶液中:C(Na+)>c(CO32 -) >c(OH-)>c(HCO3- ),故A错误;![]() =
=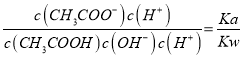 ,所以CH3COOH溶液加水稀释,溶液中
,所以CH3COOH溶液加水稀释,溶液中![]() 不变,故B正确;室温下,pH=2的盐酸与pH=12的氨水等体积混合,氨水有剩余,溶液呈碱性,氨水电离大于铵根离子水解,所以c(NH4+ )> c(Cl-),c(OH-)>c(H+),所得溶液中:c(Cl-)+c(H+)<c(NH4+ )+c(OH-),故C错误;0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,完全反应生成醋酸钠,根据质子守恒,所得溶液中:c(OH-)=c(H+)+c(CH3COOH),故D错误。
不变,故B正确;室温下,pH=2的盐酸与pH=12的氨水等体积混合,氨水有剩余,溶液呈碱性,氨水电离大于铵根离子水解,所以c(NH4+ )> c(Cl-),c(OH-)>c(H+),所得溶液中:c(Cl-)+c(H+)<c(NH4+ )+c(OH-),故C错误;0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,完全反应生成醋酸钠,根据质子守恒,所得溶液中:c(OH-)=c(H+)+c(CH3COOH),故D错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)为原料提炼铅及其化合物的工艺流程如下:
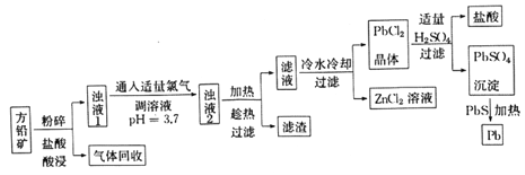
请回答下列问题:
(1)流程中“趁热过滤”的目的是______,滤渣的主要成分是_________。
(2)该工艺流程中可循环利用的物质是____________。
(3)浊液1中通入适量氯气时,发生反应的离子方程式为____________。
(4)《药性论》中有关铅丹(Pb3O4)的描述是:“治惊悸狂走,呕逆,消渴。”向铅丹中滴加浓盐酸时,产生黄绿色气体,请写出发生反应的化学方程式_________。
(5)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+)=_______。[已知Kp(PbS)=3.4×10-28,Kp(CuS)=1.3×10-36]
(6)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的浓度分数x与溶液PH变化的关系如下图所示:
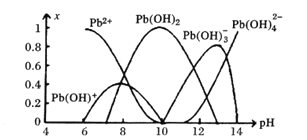
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH溶液,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH>13时,溶液中发生的主要反应的离子方程式为________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的铅和其他杂质离子,实验结果记录如下:
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
处理前浓度(mg/L) | 0.100 | 29.8 | 0.12 | 0.087 |
处理后浓度(mg/L) | 0.004 | 22.6 | 0.04 | 0.053 |
由表可知该试剂去除Pb2+比Fe3+效果好,请用表中有关数据说明_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,有两种盐的稀溶液,分别是![]() mol/L NaX溶液和
mol/L NaX溶液和![]() mol/L NaY溶液,下列判断错误的是( )
mol/L NaY溶液,下列判断错误的是( )
A. 若![]() ,测得
,测得![]() ,则溶液中的
,则溶液中的![]()
B. 若![]() ,测得
,测得![]() ,则溶液中的
,则溶液中的![]()
C. 若![]() ,且
,且![]() ,则酸性:
,则酸性: ![]()
D. 若![]() ,并测得
,并测得![]() ,则HX是强酸,HY是弱酸
,则HX是强酸,HY是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
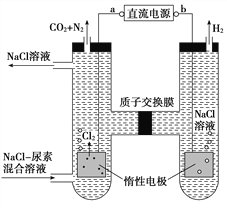
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组依据Mg与CO2的反应。推测Mg 与SO2在隔绝空气的条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验一:按如图所示进行实验。
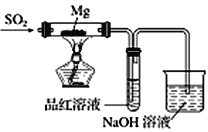
(1)实验室制取二氧化硫的化学方程式为 _________________________________。
(2)上述装置存在不合理之处,请提出一项改进建议 :___________________________。
(3)实验时,先通入SO2直到_______现象出现后,再点燃酒精灯;此操作目的是__________________。
实验二 确定固体M的成分。
实验装置如下图所示。将分液漏斗中稀硫酸(足量)加入到烧瓶中,完全反应后,实验现象如下: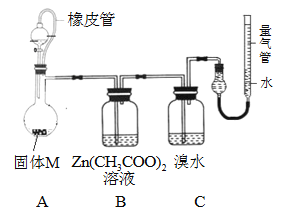
装置 | A | B | C | 量气管 |
现象 | 有残留固体 | 产生白色ZnS沉淀 | 溴水未褪色 | 进入气体v mL(标况) |
(4)实验时,B装置中反应的化学方程式为 __________________________________。
(5)已知镁的相对原子质量为24,则固体M中金属镁的质量为 _________g;实验前装置内有空气,对金属镁质量的测定结果的影响是 ____________(填“偏低”、“偏高”、“无影响”);
(6)依据以上实验,可确定固体M的成分有_________种(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下反应中,①铁丝在氧气中燃烧 ②加热碳和氧化铜的混合物③碳酸钠和硫酸反应 ④加热高锰酸钾固体 ⑤锌和稀硫酸反应 ⑥硫酸钠溶液和氯化钡溶液混合。属于离子反应的有___________(填各反应的序号,下同),属于氧化还原反应的___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)惰性电极电解硫酸铜溶液的化学方程式_____________________________。
(2)惰性电极电解饱和食盐水的化学方程式_____________________________。
Ⅱ、某小组同学认为,如果模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
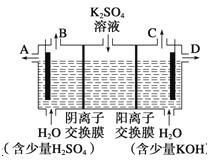
(3)该电解槽的阳极反应式为________________________________。此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(4)制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”或“D”)导出。
(5)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中与50 mL1mol/LAlCl3溶液中Cl-物质的量浓度相等的是
A. 50 mL 1 mol/LFeCl3溶液 B. 75 mL 2mol/LKCl溶液
C. 150 mL 1 mol/LMgCl2溶液 D. 25 mL 3 mol/LCuCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com