
【题目】以方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)为原料提炼铅及其化合物的工艺流程如下:
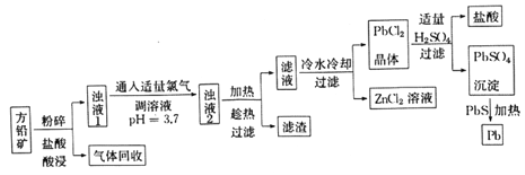
请回答下列问题:
(1)流程中“趁热过滤”的目的是______,滤渣的主要成分是_________。
(2)该工艺流程中可循环利用的物质是____________。
(3)浊液1中通入适量氯气时,发生反应的离子方程式为____________。
(4)《药性论》中有关铅丹(Pb3O4)的描述是:“治惊悸狂走,呕逆,消渴。”向铅丹中滴加浓盐酸时,产生黄绿色气体,请写出发生反应的化学方程式_________。
(5)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+)=_______。[已知Kp(PbS)=3.4×10-28,Kp(CuS)=1.3×10-36]
(6)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的浓度分数x与溶液PH变化的关系如下图所示:
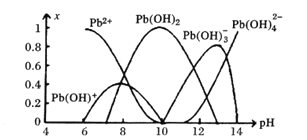
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH溶液,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH>13时,溶液中发生的主要反应的离子方程式为________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的铅和其他杂质离子,实验结果记录如下:
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
处理前浓度(mg/L) | 0.100 | 29.8 | 0.12 | 0.087 |
处理后浓度(mg/L) | 0.004 | 22.6 | 0.04 | 0.053 |
由表可知该试剂去除Pb2+比Fe3+效果好,请用表中有关数据说明_________.
【答案】 防止PbCl2结晶析出 Ag和Fe(OH)3 盐酸 2Fe2++Cl2=2Fe3++2Cl- Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O 2.6×108 Pb(OH)3-+OH-=Pb(OH)42- 加入该试剂,Pb2+的浓度转化率为(0.1-0.004)÷0.1×100%=96%;Fe3+的浓度转化率为(0.12-0.04)÷0.12×100%=67%,所以该试剂去除Pb2+比Fe3+效果好
【解析】试题分析:(1)PbCl2溶解度随温度升高而增大;根据流程图,滤液中含有Pb2+、Zn2+;(2)根据流程图,开始需要加入盐酸,最后产物有盐酸;(3)浊液1中通入适量氯气,氯化亚铁被氧化为氯化铁;(4)Pb3O4与浓盐酸发生氧化还原反应生成氯气和PbCl2; (5)Kp(PbS)=3.4×10-28>Kp(CuS)=1.3×10-30,当PbS开始沉淀时,一定有CuS沉淀,c(Pb2+)/c(Cu2+)等于溶度积的比;(6)①根据图示,pH>13时,Pb(OH)3-与氢氧化钠反应生成Pb(OH)42-;②根据浓度转化率分析;
解析:(1)PbCl2溶解度随温度升高而增大,流程中“趁热过滤”可以防止PbCl2结晶析出;根据流程图,滤液中含有Pb2+、Zn2+,所以滤渣中有Ag和Fe(OH)3;(2)根据流程图,开始需要加入盐酸,最后产物有盐酸,可循环利用的物质是盐酸;(3)浊液1中通入适量氯气,氯化亚铁被氧化为氯化铁,反应离子方程式是2Fe2++Cl2=2Fe3++2Cl-;(4)Pb3O4与浓盐酸发生氧化还原反应生成氯气和PbCl2,反应化学方程式是Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O;(5) Kp(PbS)=3.4×10-28>Kp(CuS)=1.3×10-36,当PbS开始沉淀时,一定有CuS沉淀,c(Pb2+)/c(Cu2+)= Kp(PbS)/Kp(CuS)= ![]() 2.6×108 ;(6)①pH>13时,Pb(OH)3-与氢氧化钠反应生成Pb(OH)42-,反应离子方程式是Pb(OH)3-+OH-=Pb(OH)42- ;②加入该试剂,Pb2+的浓度转化率为(0.1-0.004)÷0.1×100%=96%;Fe3+的浓度转化率为(0.12-0.04)÷0.12×100%=67%,所以该试剂去除Pb2+比Fe3+效果好。
2.6×108 ;(6)①pH>13时,Pb(OH)3-与氢氧化钠反应生成Pb(OH)42-,反应离子方程式是Pb(OH)3-+OH-=Pb(OH)42- ;②加入该试剂,Pb2+的浓度转化率为(0.1-0.004)÷0.1×100%=96%;Fe3+的浓度转化率为(0.12-0.04)÷0.12×100%=67%,所以该试剂去除Pb2+比Fe3+效果好。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
图1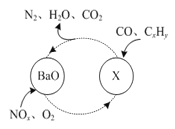 图2
图2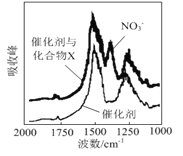
①在图示的转化中,被还原的元素是_______________,X的化学式为________________。
②钡元素在周期表中的位置是_________________。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式:___________________。
(3)利用ClO2 氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的化学方程式是2NO + ClO2 + H2O == NO2 + HNO3 + 2HCl,反应Ⅱ的离子方程式是______________。
(4)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_________________。
②检验废水中是否存在NH4+的方法是____________________________。
③若处理废水产生了0.448LN2(标准状况),则需消耗浓度为2mol·L-1的次氯酸钠的体积为_______________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
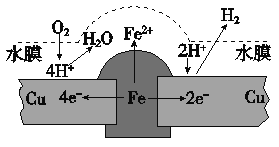
A. 因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B. 若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C. 铜极上的反应是2H+ + 2e- = H2↑,O2 + 4e-+ 4H+ = 2H2O
D. 在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________;
②加入催化剂________;
③充入更多的H2________;
④保持容器中压强不变,充入氖气________;
⑤保持容器容积不变,通入氖气________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系为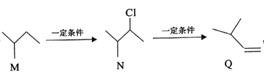 ,下列说法不正确的是
,下列说法不正确的是
A. M的名称为异丁烷
B. N的同分异构体有7种(不考虑立体异构,不包括本身)
C. M![]() N、N
N、N![]() Q的反应类型分别为取代反应和消去反应
Q的反应类型分别为取代反应和消去反应
D. M、N、Q均能使溴水层褪色,但原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙齿表面由一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:Ca5(PO4)3OH![]() 5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
A. 少吃甜食 B. 多喝碳酸饮料
C. 在牙膏中加入氟化物添加剂 D. 在牙膏中添加适量的Ca2+或PO43-离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X和Y两元素组成化合物A和B,A的化学式为XY2,其中X占44.1%,B中X占34.5%,则B的化学式为( )
A.X2YB.XYC.XY3D.X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高压电机,复印机工作时会产生臭氧,该气体有强氧化性。下列叙述不正确的是( )
A、臭氧和氧气互为同素异形体 B、臭氧可使KI淀粉试纸变蓝
C、臭氧的存在对人体有益无害 D、臭氧是很好的消毒剂和脱色剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是
A. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32 -)>c(HCO3- )>c(OH-)
B. CH3COOH溶液加水稀释,溶液中![]() 不变
不变
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D. 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com