
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
图1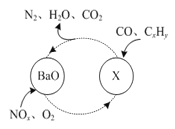 图2
图2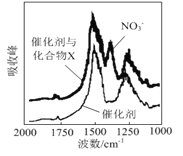
①在图示的转化中,被还原的元素是_______________,X的化学式为________________。
②钡元素在周期表中的位置是_________________。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式:___________________。
(3)利用ClO2 氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的化学方程式是2NO + ClO2 + H2O == NO2 + HNO3 + 2HCl,反应Ⅱ的离子方程式是______________。
(4)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_________________。
②检验废水中是否存在NH4+的方法是____________________________。
③若处理废水产生了0.448LN2(标准状况),则需消耗浓度为2mol·L-1的次氯酸钠的体积为_______________mL。
【答案】 N、O Ba(NO3)2 第六周期第IIA族 16NH3+12NO+6NO2=17N2+24H2O 2NO2+4SO32-=N2+4SO42- ![]() 取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成NH4+ 30
取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成NH4+ 30
【解析】(1)考查氧化还原反应、元素周期表位置等,①被还原的元素化合价降低,根据图1,化合价降低的元素是N和O,根据元素守恒,X中应含有Ba元素,根据图2,X中含有NO3-,因此化合物X的化学式为Ba(NO3)2;②钡元素位于第六周期IIA族;(2)考查氧化还原反应方程式的书写,氮的氧化物与NH3反应生成无害物质,即N转化成N2,NO与NH3的反应方程式6NO+4NH3=5N2+6H2O,NO2与NH3发生反应的方程式为6NO2+8NH3=7N2+12H2O,因此NO与NO2物质的量之比为2:1,因此总反应方程式为:16NH3+12NO+6NO2=17N2+24H2O;(3)考查离子方程式的书写、氧化还原反应,根据反应NO2→N2,N的化合价降低,NO2作氧化剂,SO32-作还原剂,SO32-被氧化成SO42-,离子反应方程式为2NO2+4SO32-=N2+4SO42-;(4)考查化学用语、离子检验、化学计算,①NaClO属于离子化合物,其电子式为![]() ;②检验NH4+的方法:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则A中生成NH4+ ;③根据得失电子数目守恒,V(NaClO)×10-3×2×2=0.448×2×3/22.4,解得V(NaClO)=30mL。
;②检验NH4+的方法:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则A中生成NH4+ ;③根据得失电子数目守恒,V(NaClO)×10-3×2×2=0.448×2×3/22.4,解得V(NaClO)=30mL。


科目:高中化学 来源: 题型:
【题目】如图示是由3个圆所构成的类别关系图,其中I为大圆,II和III分别为大圆之内的小圆。下列选项中符合这种类别关系的是( )
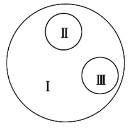
A. I: DNA II: RNA III:核酸
B. I:还原性糖 II:果糖 III:蔗糖
C. I:固醇 II:胆固醇 III:维生素D
D. I:蛋白质 II:酶 III:激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,判断下列叙述错误的是

A. 如图所示实验能够证明碳酸的酸性强于硅酸
B. 如图所示实验可证明元素的非金属性:Cl>C>Si
C. 如图所示实验中没有可以设计原电池的化学反应
D. 如图实验开始前需要打开分液漏斗的上口瓶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-鸢尾酮香料的分子结构如图,下列说法不正确的是
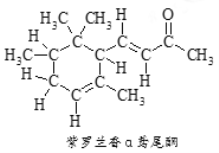
A. α-鸢尾酮可与某种酚互为同分异构体
B. 1 mol α-鸢尾酮最多可与3molH2加成
C. α-鸢尾酮能发生银镜反应
D. α-鸢尾酮经加氢→消去→加氢三步反应可转变为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。
采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如图:

资料:①Ag+SCN-==AgSCN↓:Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POC13的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POC13 | 2.0 | 106.0 | 153.5 |
(1)B中所盛的试剂是________,干燥管的作用是_____________________。
(2)POC13遇水反应的化学方程式为____________________________。
(3)装置B的作用除干燥O2外,还有_____________________________。
(4)反应温度要控制在60~65℃,原因是:____________________________。
II.测定POC13产品的含量。
实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7g POC13产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液。
②取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mLKSCN溶液。
(5)步骤③中加入硝基苯的作用是__________________________。
(6)步骤④中X为____________________ 。
(7)反应中POC13的百分含量为_________,通过__________(填操作)可以提高产品的纯度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喹啉醛H 是一种可用于制备治疗肿瘤药物的中间体。由烃A制备H的合成路线如下:

巳知:i.RCCl3![]() RCOOK;ii.反应④中,吡啶作稳定剂
RCOOK;ii.反应④中,吡啶作稳定剂
回答下列问题:
(1)A的化学名称是__________________________。
(2)①、⑥的反应类型分别为_______________、________________。
(3)D为链状结构,分子中不含“—O—”结构,且不能发生银镜反应,其核磁共振氢谱为3组峰,峰面积比为3:2:1,D的结构简式为________________________。
(4)反应④的化学方程式为______________________________________。
(5)下列有关G的说法正确的是________________ (填标号)。
a.经质谱仪测定,G只含有羧基、碳碳双健两种官能团
b.属于萘的衍生物
c.一定条件下可发生加聚反应
d.可与少量Na2CO3溶液反应生成NaHCO3
(6)X是H的同分异构体,两者环状结构相同,X环上的取代基与H的相同但位置不同,则X可能的结构有____种。
(7)写出用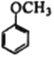 为原料制备
为原料制备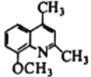 的合成路线________________(其他试剂任选)。
的合成路线________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
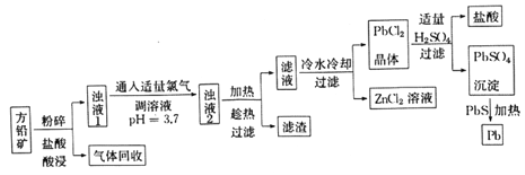
【题目】以方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)为原料提炼铅及其化合物的工艺流程如下:
请回答下列问题:
(1)流程中“趁热过滤”的目的是______,滤渣的主要成分是_________。
(2)该工艺流程中可循环利用的物质是____________。
(3)浊液1中通入适量氯气时,发生反应的离子方程式为____________。
(4)《药性论》中有关铅丹(Pb3O4)的描述是:“治惊悸狂走,呕逆,消渴。”向铅丹中滴加浓盐酸时,产生黄绿色气体,请写出发生反应的化学方程式_________。
(5)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+)=_______。[已知Kp(PbS)=3.4×10-28,Kp(CuS)=1.3×10-36]
(6)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的浓度分数x与溶液PH变化的关系如下图所示:
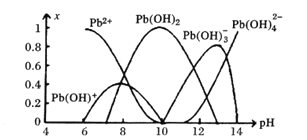
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH溶液,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH>13时,溶液中发生的主要反应的离子方程式为________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的铅和其他杂质离子,实验结果记录如下:
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
处理前浓度(mg/L) | 0.100 | 29.8 | 0.12 | 0.087 |
处理后浓度(mg/L) | 0.004 | 22.6 | 0.04 | 0.053 |
由表可知该试剂去除Pb2+比Fe3+效果好,请用表中有关数据说明_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com