
【题目】某小组同学利用下列实验探究金属铝与不同铜盐溶液的反应:
实验 | 实验方案 | 现象 |
1 | 向5mLlmol/LCuSO4溶液中加入用砂纸打磨过的铝片 | 铝片表面无明显现象,20min后铝片表面有极少气泡,且有很少量红色物质生成 |
2 | 向5mLlmol/LCuCl2溶液中加入用砂纸打磨过的铝片 | 铝片表面有气泡产生,同时有红色物质析出,1min后反应进一步加快,放出大量的热,有少量黑色固体生成。一段时间后烧杯底部出现白色沉淀 |
(1)打磨铝片的目的是_____________________________。
(2)实验中出现的红色物质是_______________________________。
(3)实验2中“1min后反应进一步加快”的原因是________________________________。
(4)经检验实验1、2中产生的无色气体是H2,黑色固体为CuO,试用离子方程式解释H2产生的原因__________________________,用文字简述黑色固体产生的原因____________________________。
(5)依据上述实验1、2现象推测并判断,用砂纸打磨后的铝片分别与H+浓度均为0.2molL-1的盐酸和硫酸反应,反应速率:前者比后者____________(填“快”或“慢”)
(6)经证明实验2 中白色沉淀的化学成分为CuCl。某同学猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有________性。依据猜测他进行了如下实验:取Cu粉与适量1mol/LCuCl2溶液混合,一段时间后观察无白色沉淀产生。该同学再次分析Al 与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,他的改进方法为__________________。
【答案】 除去表面的氧化物膜 Cu 或铜 Cu和Al在酸性条件下形成原电池,加快反应速率 Cu2++2H2O![]() Cu(OH)2+2H+ 2Al+6H+ = 3H2↑+2Al3+ Cu2+水解生成的 Cu(OH)2 受热分解生成黑色的 CuO 快 还原 加热后观察
Cu(OH)2+2H+ 2Al+6H+ = 3H2↑+2Al3+ Cu2+水解生成的 Cu(OH)2 受热分解生成黑色的 CuO 快 还原 加热后观察
【解析】(1)打磨铝片可以除去表面的氧化物薄膜,故答案为:除去表面的氧化物膜;
(2)铝的活泼性比铜强,能够置换出硫酸铜溶液中的铜,因此实验中出现的红色物质是铜,故答案为:铜;
(3) “1min后,置换出来的Cu和Al在酸性条件下形成原电池,加快反应速率,故答案为:Cu和Al在酸性条件下形成原电池,加快反应速率;
(4)CuSO4是强酸弱碱盐,水解后溶液显酸性,金属铝能够与酸反应放出氢气,反应过程中放出的热量使水解生成的氢氧化铜分解为黑色的氧化铜,故答案为:Cu2++2H2O![]() Cu(OH)2+2H+、2Al+6H+ = 3H2↑+2Al3+; Cu2+水解生成的 Cu(OH)2 受热分解生成黑色的 CuO;
Cu(OH)2+2H+、2Al+6H+ = 3H2↑+2Al3+; Cu2+水解生成的 Cu(OH)2 受热分解生成黑色的 CuO;
(5)实验1水解生成硫酸,反应速率慢,实验2水解生成盐酸,反应速率快,因此用砂纸打磨后的铝片分别与H+浓度均为0.2molL-1的盐酸和硫酸反应,盐酸反应速率快,故答案为:快;
(6)铜是活泼性差一点的金属,但反应中仍能够失去电子,体现还原性,因此猜测Cu与CuCl2溶液反应生成了CuCl是合理的,铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程放出大量热量,证明了Cu与CuCl2溶液反应生成CuCl,可以加热观察是否生成白色沉淀,若加热出现沉淀说明Cu与CuCl2溶液反应生成了CuCl,若不出现沉淀说明Cu与CuCl2溶液不能反应生成了CuCl,故答案为:加热后观察现象。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】在如图所示的体检指标中,表示总胆红素指标的物理量是( )
项目名称 结果 单位 参考值
1谷丙转氨酶 7 U/L <40
2谷草转氨酶 16 U/L 0-40
3谷酰转肽酶 15 U/L 0-50
4碱性磷酸酶 77 U/L 34-114
5总胆红素 12.3 mmol/L 0-19
A.质量分数B.溶解度C.摩尔质量D.物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
(1)实验室中少量的钠通常保存在_______中,在实验室中取用钠的仪器是________.
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成 色的固体,写出该产物与H2O反应的化学方程式:________.
(3)将金属钠投入水中,发生反应的离子方程式为________
(4)该同学在实验室欲配制500mL0.1mol/L NaOH溶液.
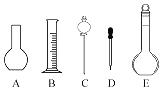
①配制溶液时肯定不需要如图所示仪器中的________(填字母),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称).
②根据计算,该同学应用托盘天平称取NaOH的质量为________.
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L.下列操作会引起所配浓度偏大的是________.
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。

A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液混合后,不会发生离子反应的是( )
A.硝酸钡溶液和硫酸钠溶液B.醋酸钠溶液和稀硫酸
C.碳酸钾溶液和稀盐酸溶液D.硝酸钾溶液和氯化铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
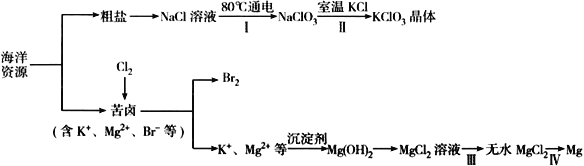
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3 晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2 溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_________
A.H2 B.N2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L 海水中95%溴元素被氧化为Br2 经热空气吹出,溴单质残留量3%。最后用SO2 将90%Br2 还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
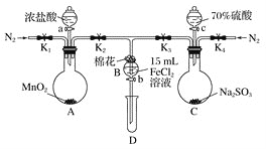
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
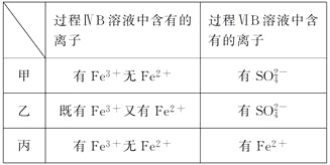
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中储有大量的化学物质,储量可观的化学元素就有80多种,其中70多种可以被人类提取利用,全世界每年都要从海洋中提取大量的食盐、铁、溴、碘、钾等有用物质,海水被誉为“液体工业原料”。
从海水中提取食盐、镁和溴的流程如图所示。回答下列问题:

(1)从海水中得到的粗盐中含Mg2+、CO32-、SO42- 等杂质离子,如用试剂BaCl2、NaOH、盐酸和Na2CO3溶液,除去杂质离子,则加入试剂的顺序是___________。
(2)氨碱工业的主要反应是电解饱和氯化钠溶液,写出反应的离子方程式___________。
(3)MgCl2·6H2O脱水过程中易水解生成碱式氯化镁,化学方程式为________。因此工业上常使MgCl2·6H2O晶体在____气体中脱水而得到干燥无水的MgCl2。
(4)第⑤步是用热空气将Br2吹入SO2 溶液中,写出反应的化学方程式________。
(5)电解无水MgCl2 可得金属镁和氯气,利用副产品氯气还可制备漂白粉,其反应的化学方程式为_______。
(6)步骤④中用硫酸酸化可提高Cl2 的利用率,理由是_______________________。含高浓度Br2 的水溶液经过蒸馏可得到Br2,蒸馏的温度为80~90℃,温度过高或过低都不利于生产,请解释原因:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA表示阿伏加德罗常数的值,下列叙述正确的是(
A. 常温常压下,含有 NA个氮原子的氮气体积约为 11.2L
B. 标准状况下,64gSO2中含有的原子数为 3NA
C. 在常温常压下,11.2L Cl2含有的分子数为 0.5NA
D. 标准状况下,11.2L H2O 含有的分子数为 0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com