
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
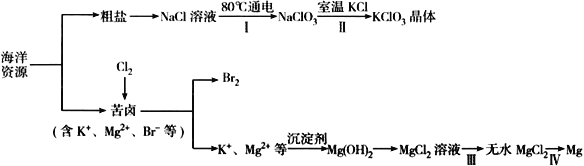
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3 晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2 溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_________
A.H2 B.N2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L 海水中95%溴元素被氧化为Br2 经热空气吹出,溴单质残留量3%。最后用SO2 将90%Br2 还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
【答案】 NaOH 溶液 Na2CO3溶液 NaCl+3H2O═NaClO3+3H2↑ 室温下 KClO3在水中的溶解度明显小于其它晶体 MgCl2+H2O![]() Mg(OH)Cl+HCl↑ 在干燥的 HCl 气流下加热 A 提高溴离子的浓度, 富集溴元素 16.6倍
Mg(OH)Cl+HCl↑ 在干燥的 HCl 气流下加热 A 提高溴离子的浓度, 富集溴元素 16.6倍
【解析】(1)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,故答案为:NaOH溶液;Na2CO3溶液;
(2)步骤Ⅰ为电解氯化钠溶液生成氯酸钠的反应,反应的总化学方程式为NaCl+3H2O═NaClO3+3H2↑,故答案为:NaCl+3H2O═NaClO3+3H2↑;
(3)相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;故答案为:室温下,氯酸钾在水中的溶解度明显小于其他晶体;
(4)如果直接在空气中加热MgCl2则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解;其反应方程式为:MgCl2+H2O ![]() Mg(OH)Cl+HCl↑,故答案为:MgCl2+H2O
Mg(OH)Cl+HCl↑,故答案为:MgCl2+H2O ![]() Mg(OH)Cl+HCl↑;
Mg(OH)Cl+HCl↑;
(5)如果直接在空气中加热MgCl2则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解,故答案为:在干燥的 HCl 气流下加热;
(6)镁能与氧气反应生成氧化镁、与氮气反应生成氮化镁、与二氧化碳反应生成氧化镁和碳,与氢气不反应,故选A;
(7)海水中95%溴元素被氧化为Br2经热空气吹出,用SO2将90%Br2还原成Br-,经过这些操作后,溶液的溴离子的浓度增大,属于富集溴元素的过程;富集后的溴离子的质量为65mg×(95%-3%)×90%,因此所得溶液中溴离子浓度为海水中溴离子浓度的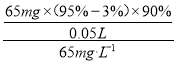 =16.6,故答案为:提高溴离子的浓度,富集溴元素;16.6。
=16.6,故答案为:提高溴离子的浓度,富集溴元素;16.6。


科目:高中化学 来源: 题型:
【题目】短周期主族元素X﹑Y﹑Z﹑W﹑Q的原子序数逐渐增大。X原子核外最外层电子数是次外层电子数的2倍。Y的氟化物YF3分子中各原子均满足最外层8电子稳定结构。Z﹑W是常见金属,Z是同周期中原子半径最大的元素。W的简单离子是同周期中离子半径最小的。X和Z原子序数之和与Q的原子序数相等。下列说法正确的是
A. 相同质量的Z和W单质分别与足量稀盐酸反应时,Z的单质获得的氢气多
B. X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同
C. 最高价氧化物对应的水化物的酸性:X<W
D. Y的简单气态氢化物与Q的单质反应,现象是产生白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,则无色溶液中
A.只有Na+B.一定有Na+,可能有K+
C.一定有Na+和K+D.可能有Na+和K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已知下列物质燃烧的化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ.mol-1。
在此条件下,下列叙述正确的是
A. C(s)+2H2(g)=CH4(g) △H=+75.5kJ·mol-1
B. CH4(g)+O2(g)=C(s)+2H2O(g) △H=-1283.5kJ.mol-1
C. 1molH2(g)和3molCH4(g)燃烧共放热2956kJ.mol-1
D. 相同质量的H2和CH4充分燃烧时,H2放出的热量约等于CH4放出的热量的2.57倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下列实验探究金属铝与不同铜盐溶液的反应:
实验 | 实验方案 | 现象 |
1 | 向5mLlmol/LCuSO4溶液中加入用砂纸打磨过的铝片 | 铝片表面无明显现象,20min后铝片表面有极少气泡,且有很少量红色物质生成 |
2 | 向5mLlmol/LCuCl2溶液中加入用砂纸打磨过的铝片 | 铝片表面有气泡产生,同时有红色物质析出,1min后反应进一步加快,放出大量的热,有少量黑色固体生成。一段时间后烧杯底部出现白色沉淀 |
(1)打磨铝片的目的是_____________________________。
(2)实验中出现的红色物质是_______________________________。
(3)实验2中“1min后反应进一步加快”的原因是________________________________。
(4)经检验实验1、2中产生的无色气体是H2,黑色固体为CuO,试用离子方程式解释H2产生的原因__________________________,用文字简述黑色固体产生的原因____________________________。
(5)依据上述实验1、2现象推测并判断,用砂纸打磨后的铝片分别与H+浓度均为0.2molL-1的盐酸和硫酸反应,反应速率:前者比后者____________(填“快”或“慢”)
(6)经证明实验2 中白色沉淀的化学成分为CuCl。某同学猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有________性。依据猜测他进行了如下实验:取Cu粉与适量1mol/LCuCl2溶液混合,一段时间后观察无白色沉淀产生。该同学再次分析Al 与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,他的改进方法为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物由碳、氢、氧三种元素组成,其红外光谱图只有C—H键、O—H键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是
A. CH3CH2OCH3 B. CH3CH(OH)CH3 C. CH3CH2CH2CH2OH D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。

①分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因_________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因____________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系________,理由____________。

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是___________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com