
����Ŀ���������������г��������ֽ�����
��1���������������ڻ��������䣬ԭ����_________________________________________����������ס�����ƣ������������ϴ�ЩС�ף������Ӽ�ס����ˮ�У����ܷ����ķ�Ӧ�û�ѧ����ʽ��ʾΪ�� ___________________________��__________________________________�������ᷴӦ�����ӷ���ʽΪ��__________________________________��
��2���ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ����ͼװ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱����ش��ʵ���е����⡣
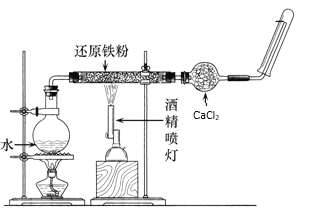
��д���÷�Ӧ�ķ�Ӧ����ʽ����˫���ű������תת�Ʒ������Ŀ��______________________
����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ��������________________________��
�۾ƾ��ƺ;ƾ�������ȵ�ȼ����__________________________��
��������5.6 gFe��ȫ�ܽ���ϡ�����У���ˮ���200 mL��Һ����������������Һ�����ʵ���Ũ��______________��Ӧ��ת�Ƶĵ�������_________�����ɵ������ڱ�״���µ������______________L��
���𰸡���������һ�����ܵ�����ĤAl2O3 ,Al2O3�۵�� 2Na+2H2O == 2NaOH + H2 �� 2Al+2H2O+2NaOH == 2NaAlO2 + 3H2 �� 2Al+6H+ == 2Al3++3H2 ��  ��ֹ���� �ƾ��� 0.5mol/L 0.2NA 2.24L
��ֹ���� �ƾ��� 0.5mol/L 0.2NA 2.24L
��������
���ݽ��������������ʷ�����𣻸������ʵ����ڻ�ѧ��Ӧ�еļ��������𣻸������ӷ���ʽ����д����������
(1) �������������ڻ��������䣬�����ڽ������ڿ����б�������������һ�����ܵ�����Ĥ����ֹ��Ӧ�Ľ�һ�����У����������Ĥ�۵�ߣ����������ͻ���ϣ���������ס�����ƣ������������ϴ�ЩС�ף������Ӽ�ס����ˮ�У���������ˮ��Ӧ�����������ƣ��������������������Ӧ�����Է�����������Ӧ���ʷ���ʽΪ��2Na+2H2O == 2NaOH + H2 ����2Al+2H2O+2NaOH == 2NaAlO2 + 3H2 ����
�ʴ�Ϊ����������һ���۵�ߵ����ܵ�����Ĥ��2Na+2H2O == 2NaOH + H2 ���� 2Al+2H2O+2NaOH == 2NaAlO2 + 3H2 ����2Al+6H+ == 2Al3++3H2 �� ��
(2) ��������ˮ�����ڸ����·����ķ�Ӧ�У����ϼ����ߵ�Ԫ������Ԫ�أ�ʧȥ���ӣ����ϼ۽���Ԫ������Ԫ�أ��õ����ӣ�����ת�����������ʾ��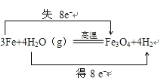 ��
��
�ʴ�Ϊ�� ��
��
����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ�������Ƿ�ֹ���У�
�ʴ�Ϊ����ֹ���У�
��Ӧ�ȵ�ȼ�ƾ��ƣ������ȶ���ˮ������ʱ���ڵ�ȼ�ƾ���ƣ�
�ʴ�Ϊ���ƾ��ƣ�
��5.6 gFe�����ʵ���Ϊ��0.1mol�������������������ʵ���Ϊ��0.1mol����Һ�����Ϊ��200mL�����������������ʵ���Ũ��Ϊ��c=![]() =
=![]() =0.5mol/L����Ӧ������Fe��0��������+2�ۣ�ʧȥ2�����ӣ���0.1mol��Feʧȥ0.2mol�ĵ��ӣ�ʧȥ���ӵ���ĿΪ��0.2NA�����ݷ���ʽ��Fe+H2SO4=FeSO4 + H2������֪0.1molFe��������0.1mol������״���£����������Ϊ��V=n��22.4L/mol=0.1mol��22.4L/mol=2.24L��
=0.5mol/L����Ӧ������Fe��0��������+2�ۣ�ʧȥ2�����ӣ���0.1mol��Feʧȥ0.2mol�ĵ��ӣ�ʧȥ���ӵ���ĿΪ��0.2NA�����ݷ���ʽ��Fe+H2SO4=FeSO4 + H2������֪0.1molFe��������0.1mol������״���£����������Ϊ��V=n��22.4L/mol=0.1mol��22.4L/mol=2.24L��
�ʴ�Ϊ��0.5mol/L�� 0.2NA ��2.24L��


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ˮ��Һ���ܹ������������
A. K+��OH����CO32��B. Ba2+��H+��SO42��
C. H+��OH����NO3��D. Fe3+��Cl����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ������ͭ���ֽ�����ĩ����������������ַ�Ӧ�����˺�����Һ�м�������ռ���Һ���ٹ��ˣ������к��У� ��
A.Al(OH)3B.Cu(OH)2C.Mg(OH)2D.Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������H+ + OH- = H2O��ʾ�Ļ�ѧ����ʽΪ
A. ϡH2SO4��Ba(OH)2��Һ��Ӧ B. Cu(OH)2�����ᷴӦ
C. KOH��Һ��ϡH2SO4��Ӧ D. NaOH��Һ��CH3COOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ��߾���I��J���������������й㷺Ӧ�ã���ϳ�·����ͼ:

������R�ķ���ʽΪC9H10���䱽����ֻ��һ��ȡ������R��H21:1�ӳɺ����ĺ˴Ź�����������5��壬�����֮��Ϊ1:2:2:1:6��
��֪:R'CH=CH2![]() R'CH2CH2Br
R'CH2CH2Br
�ش���������:
(1)������R���ӵĹ�������_________(������ŷ���)��R�����ͬϵ����_____(�ѧ����)��
(2)��Ӧ���Ļ�ѧ����ʽΪ__________________��
(3)�������ķ�Ӧ���ͷֱ�����____________��______________________��
(4)�߾���J�Ľṹ��ʽΪ________________________��
(5)��Ӧ���ķ�Ӧ������______________________��
(6)H��T��Ϊͬ���칹�壬������������������H���ӹ���________�֡�
���ܷ���������Ӧ�����Ȼ�����Һ��Ӧ����ɫ����ʹ���������̼��Һ��ɫ
(7)���������ϳ�·�ߣ����һ����RΪ��Ҫԭ���Ʊ� �ĺϳ�·��(���Լ���ѡ):____________________________________________________��
�ĺϳ�·��(���Լ���ѡ):____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ˮ�к�����̬�ȣ�ͨ������ʵ��ⶨ��Ũ�ȡ�
��ȡˮ��10.00mL����ƿ�У�����10.00mL��KI��Һ(����),�����ķ�ӦΪ:Cl2+2KI=2KCl+I2������ָʾ��2��3�Ρ�
��ȡһ�ζ�������������ˮ������ˮϴ��������ע��0.01mol/L��Һ������Һ�棬���¶�����
�۽���ƿ���ڵζ����½��еζ��������ķ�ӦΪ:I2+2Na2S2O3=2NaI+2Na2S4O6��
�Իش���������:
(1)����ټ����ָʾ����_____________��
(2)�����Ӧʹ��______ʽ�ζ��ܡ�
(3)�жϴﵽ�ζ��յ��ʵ��������_____________��
(4)��0.1032mol/LHCl��Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ�����������ʵ������Ӱ�����___(����)��
A.��ʽ�ζ���δ�ñ�������Һ��ϴ
B.��ƿδ�ô���Һ��ϴ
C.�ζ��ζ��ܼ����������ݣ��ζ���������ʧ��
D.�ζ�ʱ����Һ������ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��M��NΪ���ֶ�����Ԫ�أ���ԭ�Ӱ뾶������������֮��Ĺ�ϵ����ͼ��ʾ��
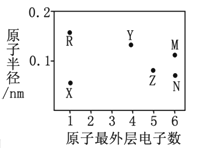
��1��MԪ�ص�ԭ�Ӻ�����__________��������ͬ�ĵ��ӣ���__________��δ�ɶԵ��ӣ�ZԪ����Ԫ�����ڱ��е�λ���ǵ�______����________�塣
��2��N��R��X����Ԫ�ص�ԭ�ӿɹ���һ��ǿ�������ʣ������ʵĵ���ʽ��_____________��YԪ�ص���������������˵���Ҫ���ϣ�����������________���壨������ͣ���
ij���������ĺ��Ļ��ڵķ�ӦΪ��2MN2(g) + N2(g) 2 MN3(g) + Q��Q��0��
��3���÷�Ӧ��ƽ�ⳣ������ʽK=__________________________����ʹKֵ��ɲ�ȡ�Ĵ�ʩ��__________________________��
��4���÷�Ӧ�ﵽƽ����������������������£���ʹ�������������Ϊԭ������������ƽ��____________________����ѡ���������ƶ������������ƶ����������ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ժ�CO2������Ӧ��Fe(s)��CO2(g)![]() FeO(s)��CO(g)��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ.����˵������ȷ����
FeO(s)��CO(g)��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ.����˵������ȷ����

A. a��Ϊƽ��״̬
B. b���c��Ļ�ѧƽ�ⳣ��K��ͬ
C. �÷�Ӧ�Ļ�ѧƽ�ⳣ����ʾΪK =[CO]��[FeO]/[CO2]��[Fe]
D. ���¶����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣ��K������÷�Ӧ�� ��H �� 0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com