
【题目】下列物质中,有顺反异构体的是 ( )
A. 1,1-二氯乙烯 B. 丙烯 C. 2-丁烯 D. 1-丁烯
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。

试确定A、B、C、D、X各代表何种溶液。
A:________,B:__________,C:_________,D:_________,X:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F筒称PETA,可利用于新型的普适无卤阻燃体系。图是以A为原料合成聚合物F的路线:
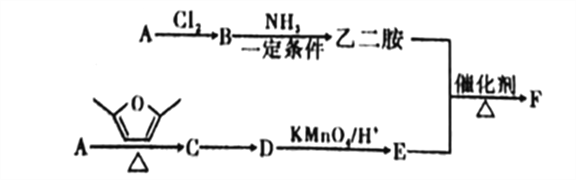
已知: ①A为与氢气的相对密度是14的烃;
②![]() ;
;
③D、E均为芳香化合物,它们的核磁共振氢谱显示均为2组峰。
回答下列问题:
(1)A中的官能团名称为_______,B的名称是______。
(2)B与NH3在一定条件的反应类型为___________。
(3)C的结构简式为___________。
(4)由C转化为D的反应中,除D外,另外一种生成物是___________。
(5)乙二胺和E反应生成聚合物F的化学方程式为___________,反应类型为___________。
(6)E的同分异构体中,满足以下条件的共有_____种(不含立体异构)。
①遇到FeCl3溶液会显色;②能发生银镜反应;③能与NaHCO3溶液反应。
(7)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备![]() 的合成路线:_____________________________。
的合成路线:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是
A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D. 如图所示是树林中的晨曙,该反应与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备FeCO3的流程如下:

(1)“酸溶”时加快反应速率的方法有______(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:
FeS2+14Fe3++8H2O![]() 15Fe2++2S
15Fe2++2S![]() +16H+,则另一个反应的离子方程式为_________。
+16H+,则另一个反应的离子方程式为_________。
②加入FeS2还原后,检验Fe3+是否反应完全的方法是______________________。
(3)①“沉淀”时,需要控制温度在35 ℃以下,其可能原因是___________________。
②所得FeCO3需充分洗涤,检验沉淀已洗净的方法是______________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_______(填化学式)。
(5)写出在空气中煅烧FeCO3制备高纯氧化铁的化学方程式:_________________。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,则Fe2O3的质量为____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式:____________________,反应后得到的溶液呈________色。用此溶液分别做如下实验:
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈________色,停止加热,即制得Fe(OH)3胶体。
(3)将制得的胶体放入半透膜制成的袋内,如图所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象,这个实验可以用来区别___________________;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为___________________________________________
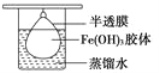
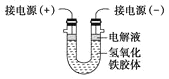
(4)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的溶度积常数见下表:

(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入_______调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________________。
(2)过滤后,将所得滤液经过________________操作,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是________________。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过呈KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I-)。
+2I-)。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com