
����Ŀ���ۺ���FͲ��PETA,�����������͵�������±��ȼ��ϵ��ͼ����AΪԭ�Ϻϳɾۺ���F��·��:
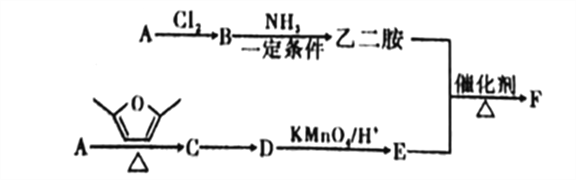
��֪: ��AΪ������������ܶ���14������
��![]() ��
��
��D��E��Ϊ���㻯������ǵĺ˴Ź���������ʾ��Ϊ2��塣
�ش���������:
��1��A�еĹ���������Ϊ_______��B��������______��
��2��B��NH3��һ�������ķ�Ӧ����Ϊ___________��
��3��C�Ľṹ��ʽΪ___________��
��4����Cת��ΪD�ķ�Ӧ�У���D�⣬����һ����������___________��
��5���Ҷ�����E��Ӧ���ɾۺ���F�Ļ�ѧ����ʽΪ___________����Ӧ����Ϊ___________��
��6��E��ͬ���칹���У��������������Ĺ���_____��(���������칹)��
������FeCl3��Һ����ɫ�����ܷ���������Ӧ��������NaHCO3��Һ��Ӧ��
��7�����������ϳ�·�ߣ���1,3-����ϩΪԭ��(���Լ���ѡ)������Ʊ�![]() �ĺϳ�·��:_____________________________��
�ĺϳ�·��:_____________________________��
���𰸡� ̼̼˫�� 1��2�������� ȡ����Ӧ ![]() H2O
H2O ![]() ���۷�Ӧ 10
���۷�Ӧ 10 
��������������Ϣ��AΪ������������ܶ���14������AΪ��ϩ��BΪ1.2-�������飬������Ϣ�ڣ��������ʷ����ӳɷ�Ӧ����C��![]() ����������Ϣ��D��E��Ϊ���㻯������ǵĺ˴Ź���������ʾ��Ϊ2��壬��D�ܹ������Ը��������Һ����������DΪ�Զ��ױ���EΪ�Ա������ᣬ�Ҷ����ͶԱ������ᷢ��ȡ����Ӧ�����л���F��
����������Ϣ��D��E��Ϊ���㻯������ǵĺ˴Ź���������ʾ��Ϊ2��壬��D�ܹ������Ը��������Һ����������DΪ�Զ��ױ���EΪ�Ա������ᣬ�Ҷ����ͶԱ������ᷢ��ȡ����Ӧ�����л���F��
��1�������Ϸ�����֪��AΪ��ϩ�����еĹ���������Ϊ̼̼˫����BΪ��ϩ�����������ӳɷ�Ӧ�IJ�����������1��2�������飻��ȷ�𰸣�̼̼˫����1��2�������顣
��2��BΪ1��2�������飬��NH3��һ�������ķ�Ӧ�����Ҷ�������Ӧ����Ϊȡ����Ӧ����ȷ�𰸣�ȡ����Ӧ��
��3��������Ϣ�ڣ��������ʷ����ӳɷ�Ӧ����C��C�Ľṹ��ʽΪ![]() ����ȷ����
����ȷ����![]() ��
��
��4������ԭ���غ���ɣ�C�ķ���ʽΪC8H12O��D�ķ���ʽΪC8H10��������Cת��ΪD�ķ�Ӧ�У���D�⣬����һ����������ˮ����ȷ����H2O��
��5���Ҷ����ͶԱ������ᷢ�����۷�Ӧ���ɾۺ���F�Ļ�ѧ����ʽΪ![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() �����۷�Ӧ��
�����۷�Ӧ��
��6���л����������ʽΪC8H6O4��������FeCl3��Һ����ɫ��˵�����б����ṹ���Һ��з��ǻ������ܷ���������Ӧ��˵���ṹ�к���ȩ����������NaHCO3��Һ��Ӧ���ṹ�к����Ȼ�����˸��л���ṹ�к���1�����ǻ���1��ȩ����1���Ȼ��ķ����廯��������Ľṹ����10�֣���ȷ�𰸣�10��
��7������������![]() �ṹ����2���ǻ�����2����ԭ�ӣ���Ϊ�ȴ��������������Ϣ�ڿ�֪����1,3-����ϩ�뺬��˫���Ķ��������ӳɷ�Ӧ���ɻ�ϩ�ṹ������˫���Ķ�����������1,3-����ϩ���巢��1,4�ӳɲ����������������£�
�ṹ����2���ǻ�����2����ԭ�ӣ���Ϊ�ȴ��������������Ϣ�ڿ�֪����1,3-����ϩ�뺬��˫���Ķ��������ӳɷ�Ӧ���ɻ�ϩ�ṹ������˫���Ķ�����������1,3-����ϩ���巢��1,4�ӳɲ����������������£�
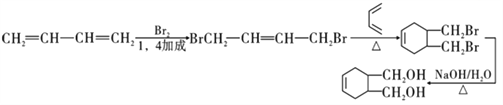 ����ȷ�𰸣�
����ȷ�𰸣�
 ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ����Ba2+ Mg2+ Ag+���������ӣ�����������NaOH��Һ��ϡ�����Na2SO4��Һ��������������һ�������룬��������ͼ��ʾ��
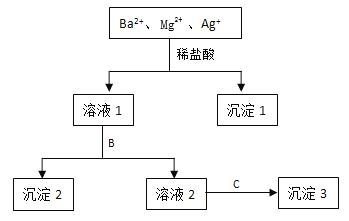
��1������1�Ļ�ѧʽΪ �����ɸó��������ӷ���ʽΪ ��
��2�����Լ�BΪNa2SO4��Һ�������2��ѧʽΪ ��
��3�����Լ�BΪNaOH��Һ�������ɳ���2�����ӷ���ʽΪ ��
��4�����ԭ��Һ��Ba2+ Mg2+ Ag+��Ũ�Ⱦ�Ϊ0.1 mol��L-1������Һ�к��е�������ֻ��NO3-������Һ��NO3- Ũ��Ϊ mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ����������������ԭ�ӵ�����������֮��Ϊ14��X��Zͬ���壬Y��Wͬ���壬��X��ԭ�Ӱ뾶С��Y������������ȷ����
A. �����Ӱ뾶��Y<Z
B. WԪ�ص��������Ӧ��ˮ����������������
C. X2Y2�������Ը��������Һ�У���ԭ����ΪX2Y
D. X��Z���ֱܷ���Y�γɺ��Ǽ��Լ��ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ���ǣ� ��
A.78gNa2O2��������H2O��Ӧ��ת�Ƶĵ�����Ϊ2NA
B.ͨ�������£�28gCO��N2�Ļ������������������ΪNA
C.��״���£�22.4LH2O�к��е�ԭ����Ϊ3NA
D.2mol/LCaCl2��Һ�У�����Cl-����Ϊ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag��(aq)��Cu(s)=Cu2��(aq)��2Ag(s)��Ƶ�ԭ�����ͼ��ʾ����ش��������⣺
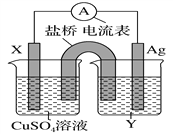
��1���缫X�IJ�����______���������ҺY��________��
��2�����缫Ϊ��ص�______���������ĵ缫��ӦʽΪ_______________��X�缫�Ϸ����ĵ缫��ӦʽΪ_________________��
��3����ͼΪֱ����Դ���ϡNa2SO4ˮ��Һ��װ�á�ͨ�����ʯī�缫a��b�����ֱ�μӼ���ʯ����Һ����缫aΪ���ص�_______����b�缫�������ֵ�����Ϊ______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����仯����������������й㷺��Ӧ�á���ش��������⣺
�ٻ�����(FeS2)�����������ұ����������Ҫԭ�ϡ�����һ����ӦΪ3FeS2+8O2=6SO2+Fe3O4����������Ϊ_____������3mol FeS2�μӷ�Ӧ��ת��__________mol���ӡ�
��FeCl3������ᷴӦʱ��������ɫ����I2���÷�Ӧ�����ӷ���ʽΪ_________________��
(2)��֪��S2O32�����н�ǿ�Ļ�ԭ�ԣ�ʵ���ҿ���I���ⶨ�ⶨK2S2O8��Ʒ�Ĵ��ȣ���Ӧ����ʽΪ��
S2O82-+2I-��2SO42-+I2��I2+2S2O32-��2I-+S4O62-��S2O82-��S4O62-��I2������ǿ��˳��_________��
(3) ��֪��Һ�У���ԭ��HSO3��>I����������IO3��> I2 > SO42�����ں�3 molNaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ������ͼ��ʾ��
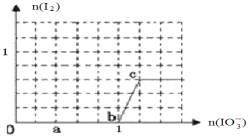
��д��a�㴦��ԭ������_______________��b�㵽c�㷴Ӧ�����ӷ���ʽ_________________________��
�ڵ���Һ�е�I��Ϊ0.5 molʱ�������KIO3Ϊ___________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���˳���칹����� ( )
A. 1��1-������ϩ B. ��ϩ C. 2-��ϩ D. 1-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⣮����Ҫ��ش�����
I�����ε�ˮ��ԭ����������Ӧ�ù㷺��������������ˮ�����侻ˮ��ԭ����_________�������ӷ���ʽ��ʾ������������������ĭ�����ԭ��֮һ����ԭ����________________�������ӷ���ʽ��ʾ����
II��5��ʱ����0.01mol CH3COONa��0.002mol HCl����ˮ���γ�1L�����Һ��
��1������Һ�д���������ƽ����ϵ���õ��뷽��ʽ�����ӷ���ʽ��ʾ��
��____________________________����____________________________����____________________________��
��2����Һ�й���__________�ֲ�ͬ������(ָ���Ӻ�����)��
��3������Щ�����У�Ũ��Ϊ0.01mol��L��1����__________��Ũ��Ϊ0.002mol��L��1����____________��
��4��__________��__________�����������ʵ���֮�͵���0.01mol��
��5����0.5mol��L��1��NaHSO3��Һ�е���ʯ���Һ��졣�Իش��й����⣺
������Һ��HSO![]() �ĵ���̶�_________(��������������С��������������)HSO
�ĵ���̶�_________(��������������С��������������)HSO![]() ��ˮ��̶ȡ�
��ˮ��̶ȡ�
����Һ��Na����HSO3����SO32����H����OH����H2SO3��H2O�����ӵ�Ũ���ɴ�С��˳��Ϊ__________��
III����Cr2O72���ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3mol��L��1��Cr2O72����Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
![]()
��1���̷�ΪFeSO4��7H2O����Ӧ��I����FeSO4��Cr2O72�� �����ʵ���֮��Ϊ_________��
��2����������������ķ�ˮ��c��Cr3+��=6.0��10��7mol��L��1��������ķ�ˮ��pH=______����Ksp[Cr��OH��3]=6.0��10��31��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����K2FeO4��ZnΪ�缫���ϣ�KOH��ҺΪ�������Һ������˵������ȷ����(����)
A. ZnΪ��صĸ��� B. ������ӦʽΪ2FeO![]() ��10H����6e��===Fe2O3��5H2O
��10H����6e��===Fe2O3��5H2O
C. �õ�طŵ�����е������ҺŨ������ D. ��ع���ʱOH����Ǩ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com