
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是( )
A. Zn为电池的负极 B. 正极反应式为2FeO![]() +10H++6e-===Fe2O3+5H2O
+10H++6e-===Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度增大 D. 电池工作时OH-向负极迁移
科目:高中化学 来源: 题型:
【题目】聚合物F筒称PETA,可利用于新型的普适无卤阻燃体系。图是以A为原料合成聚合物F的路线:
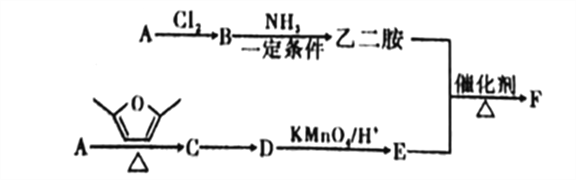
已知: ①A为与氢气的相对密度是14的烃;
②![]() ;
;
③D、E均为芳香化合物,它们的核磁共振氢谱显示均为2组峰。
回答下列问题:
(1)A中的官能团名称为_______,B的名称是______。
(2)B与NH3在一定条件的反应类型为___________。
(3)C的结构简式为___________。
(4)由C转化为D的反应中,除D外,另外一种生成物是___________。
(5)乙二胺和E反应生成聚合物F的化学方程式为___________,反应类型为___________。
(6)E的同分异构体中,满足以下条件的共有_____种(不含立体异构)。
①遇到FeCl3溶液会显色;②能发生银镜反应;③能与NaHCO3溶液反应。
(7)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备![]() 的合成路线:_____________________________。
的合成路线:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式:____________________,反应后得到的溶液呈________色。用此溶液分别做如下实验:
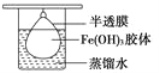
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈________色,停止加热,即制得Fe(OH)3胶体。
(3)将制得的胶体放入半透膜制成的袋内,如图所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象,这个实验可以用来区别___________________;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为___________________________________________
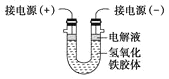
(4)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是

A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为将混有K2SO4、MgSO4的KNO3固体提纯,并制得KNO3溶液,某学生设计了如下实验方案:

(1).操作①为__________。
(2).操作②~④所加试剂的溶质依次为__________。
(3).如何判断SO42-已除尽?__________。
(4).实验过程中产生的多种沉淀__________(填“需要”或“不需要”)多次过滤,其理由是__________。
(5).该同学的实验设计方案是否严密?__________(填“严密”或“不严密”),请说明理由:__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的溶度积常数见下表:

(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入_______调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________________。
(2)过滤后,将所得滤液经过________________操作,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是________________。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过呈KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I-)。
+2I-)。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱迪生电池在充电和放电时发生反应:Fe+ NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
①放电时,电解质溶液中的阴离子向正极方向移动
②放电时,Fe参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+
④充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
A.③⑤ B.③④ C. ①③ D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com