
【题目】爱迪生电池在充电和放电时发生反应:Fe+ NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
①放电时,电解质溶液中的阴离子向正极方向移动
②放电时,Fe参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+
④充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
A.③⑤ B.③④ C. ①③ D.①⑤
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是_________(用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是________________(用离子方程式表示)。
II、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________;②____________________________;③____________________________。
(2)溶液中共有__________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol·L-1的是__________,浓度为0.002mol·L-1的是____________。
(4)__________和__________两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO![]() 的电离程度_________(填“大于”、“小于”或“等于”)HSO
的电离程度_________(填“大于”、“小于”或“等于”)HSO![]() 的水解程度。
的水解程度。
②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为__________。
III、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾为FeSO4·7H2O,反应(I)中FeSO4与Cr2O72﹣ 的物质的量之比为_________.
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=______.(Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是( )
A. Zn为电池的负极 B. 正极反应式为2FeO![]() +10H++6e-===Fe2O3+5H2O
+10H++6e-===Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度增大 D. 电池工作时OH-向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol CH4分子所含质子数为1.6 NA
B. 在0℃,101kPa时,22.4 L H2中含有NA个氢原子
C. 16 g氧气和16 g臭氧所含的原子数均为NA
D. NA个CO分子和11.2L CH4的质量比为7:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在密闭容器中的可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡状态时,4v正(O2)=5v逆(NO)
B. 当气体的平均相对分子质量不变时,反应达到平衡
C. 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 其他条件不变,增大体系压强,化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是( )
A.人类目前所直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三大化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算
(1) 1mol HCl中含有HCl分子的个数是_______________________,1.204×1023个CH4分子的物质的量是____________mol。
(2)17克NH3的物质的量是 ______ mol,0.1mol H2O的质量是______________________g。
(3)标准状况下,11.2L O2的物质的量是 ______ mol ,1mol O2的体积是 ______ L。
(4)将8g NaOH配制成1L溶液,其物质的量浓度为_______________mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量是______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制480 mL 0.5 mol/L NaOH溶液。
⑴ 该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管___________。
⑵ 其操作步骤如乙图所示,则甲图操作应在乙图中的____(填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥


⑶ 该同学应称取NaOH固体___g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
并在下图中选出能正确表示游码位置的选项____(填大写字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
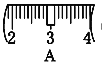

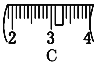
⑷ 该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是____(填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com