
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是_________(用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是________________(用离子方程式表示)。
II、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________;②____________________________;③____________________________。
(2)溶液中共有__________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol·L-1的是__________,浓度为0.002mol·L-1的是____________。
(4)__________和__________两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO![]() 的电离程度_________(填“大于”、“小于”或“等于”)HSO
的电离程度_________(填“大于”、“小于”或“等于”)HSO![]() 的水解程度。
的水解程度。
②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为__________。
III、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾为FeSO4·7H2O,反应(I)中FeSO4与Cr2O72﹣ 的物质的量之比为_________.
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=______.(Ksp[Cr(OH)3]=6.0×10﹣31)
【答案】 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Al3++3HCO3-===Al(OH)3+3CO2↑ CH3COO-+H2O
Al(OH)3(胶体)+3H+ Al3++3HCO3-===Al(OH)3+3CO2↑ CH3COO-+H2O![]() CH3COOH+OH- CH3COOH
CH3COOH+OH- CH3COOH![]() CH3COO-+H+ H2O
CH3COO-+H+ H2O![]() H++OH- 7 Na+ Cl- CH3COOH CH3COO- 大于 c(H2O)>c(Na+)>c(HSO
H++OH- 7 Na+ Cl- CH3COOH CH3COO- 大于 c(H2O)>c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)>c(H2SO3) 6:1 6
)>c(OH-)>c(H2SO3) 6:1 6
【解析】I、明矾常作净水剂,其净水的原理是明矾溶于水电离出的铝离子发生水解,生成氢氧化铝胶体,能吸附水中的悬浮颗粒并沉降下来使水变澄清,用离子方程式表示为Al3++3H2O![]() Al(OH)3(胶体)+3H+;硫酸铝常作泡沫灭火器原料之一,其原理是铝离子与碳酸氢根离子发生了双水解反应,生成了大量的含有二氧化碳的泡沫,其离子方程式为Al3++3HCO3-===Al(OH)3+3CO2↑。
Al(OH)3(胶体)+3H+;硫酸铝常作泡沫灭火器原料之一,其原理是铝离子与碳酸氢根离子发生了双水解反应,生成了大量的含有二氧化碳的泡沫,其离子方程式为Al3++3HCO3-===Al(OH)3+3CO2↑。
II、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液后,两者发生反应,生成0.002 mol CH3COOH、0.002molNaCl,余0.008mol CH3COONa.
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①CH3COO-+H2O![]() CH3COOH+OH-;②CH3COOH
CH3COOH+OH-;②CH3COOH![]() CH3COO-+H+;③H2O
CH3COO-+H+;③H2O![]() H++OH-。
H++OH-。
(2)溶液中共有CH3COO-、H2O、CH3COOH、OH-、H+、Cl-、Na+等7种不同的粒子。
(3)在这些粒子中,Cl-、Na+不参加离子反应,所以浓度为0.01mol·L-1的是Na+、浓度为0.002mol·L-1的是Cl-。
(4)由物料守恒知,CH3COOH和CH3COO-两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红,说明溶液呈酸性,进一步说明亚硫酸氢根离子在水溶液中的电离程度大于其水解程度。①该溶液中HSO![]() 的电离程度大于HSO
的电离程度大于HSO![]() 的水解程度。②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为c(H2O)>c(Na+)>c(HSO
的水解程度。②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为c(H2O)>c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)>c(H2SO3),水最多,其次是不水解的钠离子;HSO3-不论电离还是水解,其变化的程度都较小,所以HSO3-排第三位;不仅HSO3-电离出氢离子,水也电离出氢离子,所以H+排第四位;亚硫酸根只由HSO3-电离产生,所以排第五位;氢氧根既由水电离产生,也由HSO3-水解产生,所以排第六位;亚硫酸分子只由HSO3-水解产生,所以其浓度最小。
)>c(OH-)>c(H2SO3),水最多,其次是不水解的钠离子;HSO3-不论电离还是水解,其变化的程度都较小,所以HSO3-排第三位;不仅HSO3-电离出氢离子,水也电离出氢离子,所以H+排第四位;亚硫酸根只由HSO3-电离产生,所以排第五位;氢氧根既由水电离产生,也由HSO3-水解产生,所以排第六位;亚硫酸分子只由HSO3-水解产生,所以其浓度最小。
III、(1)反应(I)中,绿矾中的+2价铁化合价升高到+3价,而Cr2O72﹣中铬元素的化合价由+6下降到+3,由电子转移守恒可知,FeSO4与Cr2O72﹣ 的物质的量之比为6:1.
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的c(OH-)=![]() mol/L,则c(H+)=
mol/L,则c(H+)=![]() mol/L,所以处理后的废水的pH=6.
mol/L,所以处理后的废水的pH=6.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+ 5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。 某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:
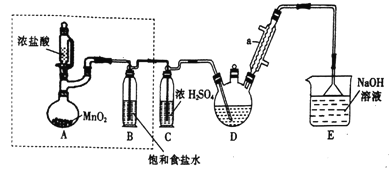
(1)仪器a的名称是______________。
(2)检查虚线框内装置气密性的方法是_________________。
(3)若撤去装置B,对实验的影响是_______________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是_______________________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO- HCOO-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L 碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2SO3溶液20.00mL。滴定时所用指示剂是______,达到滴定终点的现象是_________,测得产品的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F筒称PETA,可利用于新型的普适无卤阻燃体系。图是以A为原料合成聚合物F的路线:
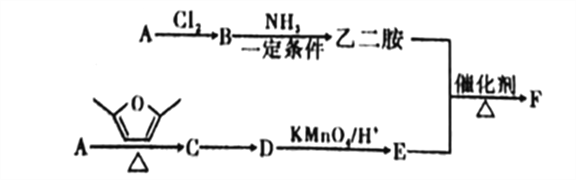
已知: ①A为与氢气的相对密度是14的烃;
②![]() ;
;
③D、E均为芳香化合物,它们的核磁共振氢谱显示均为2组峰。
回答下列问题:
(1)A中的官能团名称为_______,B的名称是______。
(2)B与NH3在一定条件的反应类型为___________。
(3)C的结构简式为___________。
(4)由C转化为D的反应中,除D外,另外一种生成物是___________。
(5)乙二胺和E反应生成聚合物F的化学方程式为___________,反应类型为___________。
(6)E的同分异构体中,满足以下条件的共有_____种(不含立体异构)。
①遇到FeCl3溶液会显色;②能发生银镜反应;③能与NaHCO3溶液反应。
(7)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备![]() 的合成路线:_____________________________。
的合成路线:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备FeCO3的流程如下:

(1)“酸溶”时加快反应速率的方法有______(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:
FeS2+14Fe3++8H2O![]() 15Fe2++2S
15Fe2++2S![]() +16H+,则另一个反应的离子方程式为_________。
+16H+,则另一个反应的离子方程式为_________。
②加入FeS2还原后,检验Fe3+是否反应完全的方法是______________________。
(3)①“沉淀”时,需要控制温度在35 ℃以下,其可能原因是___________________。
②所得FeCO3需充分洗涤,检验沉淀已洗净的方法是______________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_______(填化学式)。
(5)写出在空气中煅烧FeCO3制备高纯氧化铁的化学方程式:_________________。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,则Fe2O3的质量为____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用过量的乙酸和异成醇制备乙酸异戊酯,原理(如图所示) 和有关数据如下:
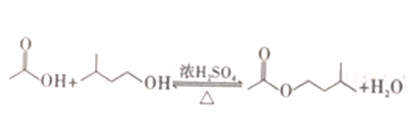
物质 | 相对分子质量 | 密度/(g·cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解度 |
异戊醇 | 88 | 0.8123 | -117 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 17 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | -78 | 142 | 难溶 |
下列说法正确的是
A. 常温下,可用过滤的方法分离乙酸异戊酯和水溶液
B. 反应中,加入过量的乙酸的主要目的是加快该反应的反应速率
C. 为了除去产物中混有的乙酸,可以向混合物中加入足量饱和Na2CO3溶液,充分振荡后静置、分液
D. 为了除去产物中混有的异戊醇,应选择如图所示装置中的c装置
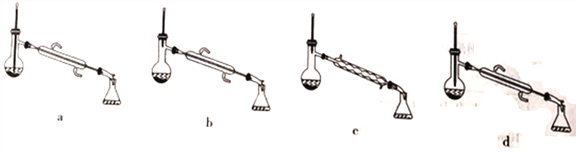
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式:____________________,反应后得到的溶液呈________色。用此溶液分别做如下实验:
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈________色,停止加热,即制得Fe(OH)3胶体。
(3)将制得的胶体放入半透膜制成的袋内,如图所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象,这个实验可以用来区别___________________;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为___________________________________________
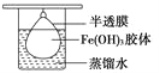
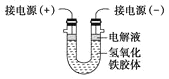
(4)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱迪生电池在充电和放电时发生反应:Fe+ NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
①放电时,电解质溶液中的阴离子向正极方向移动
②放电时,Fe参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+
④充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
A.③⑤ B.③④ C. ①③ D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com