
【题目】短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是
A. 简单离子半径:Y<Z
B. W元素的氧化物对应的水化物可能是弱电解质
C. X2Y2加入酸性高锰酸钾溶液中,还原产物为X2Y
D. X、Z都能分别与Y形成含非极性键的分子
【答案】B
【解析】短周期元素X、Y、Z、W的原子序数依次增大,X与Z同主族,Y与W同主族,则Y与W分别位于第二、第三周期,X的原子半径小于Y,X不可能处于第二周期,故X为H元素,Z为Na元素,X、Y、Z、W的原子最外层电子数之和为14,故Y、W的最外层电子数为![]() ,故Y为O元素,W为S元素。O2-与Na+的电子层结构相同,O2-的半径大于Na+,A错误;S元素的氧化物对应的水化物可能为亚硫酸,为弱电解质,B正确;当H2O2与强氧化剂酸性高锰酸钾溶液作用时,H2O2作还原剂,C错误;氢元素与氧元素形成H2O2 或H2O ,钠元素与氧元素形成Na2O2或Na2O,H2O2中含有非极性键,而Na2O2中含有非极性键,但是Na2O2属于离子化合物,不是共价化合物,无分子,D错误;正确选项B。
,故Y为O元素,W为S元素。O2-与Na+的电子层结构相同,O2-的半径大于Na+,A错误;S元素的氧化物对应的水化物可能为亚硫酸,为弱电解质,B正确;当H2O2与强氧化剂酸性高锰酸钾溶液作用时,H2O2作还原剂,C错误;氢元素与氧元素形成H2O2 或H2O ,钠元素与氧元素形成Na2O2或Na2O,H2O2中含有非极性键,而Na2O2中含有非极性键,但是Na2O2属于离子化合物,不是共价化合物,无分子,D错误;正确选项B。


科目:高中化学 来源: 题型:
【题目】卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+. 表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(1)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,最适宜选用的物质是____(填序号,下同),加入______调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.KMnO4 b.H2O2 c.MgO d.NaOH
(2)若除去溶液中的杂质离子,调节溶液的pH范围为:___________。
(3)由MgCl2溶液获得MgCl2固体的操作是:__________________。
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的Na2SO3溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-6mol·L-1],此时溶液中c(SO32-)≤__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。

试确定A、B、C、D、X各代表何种溶液。
A:________,B:__________,C:_________,D:_________,X:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+ 5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。 某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:
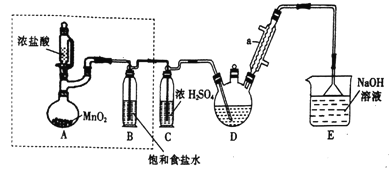
(1)仪器a的名称是______________。
(2)检查虚线框内装置气密性的方法是_________________。
(3)若撤去装置B,对实验的影响是_______________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是_______________________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO- HCOO-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L 碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2SO3溶液20.00mL。滴定时所用指示剂是______,达到滴定终点的现象是_________,测得产品的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 (g)+ O2(g) ![]() 2SO3(g),下列不能用来判断该反应达到平衡状态的是
2SO3(g),下列不能用来判断该反应达到平衡状态的是
A. 容器中压强不再变化 B. SO2的体积分数不再变化
C. 容器中混合物的密度不再变化 D. 容器中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、现象及有关结论不正确的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | 加热铝箔,铝箔熔化却不滴落 | 石蜡油分解产生的气体能使试管中溴的四氯化碳溶液褪色 | 食盐水浸泡过的铁钉放入试管中,一段时间后,导管口形成一段水柱 | 向蔗糖中加人浓硫酸时,蔗糖变黑,体积膨胀 |
结论 | 氧化铝的熔点比铝的高 | 石蜡油的分解产物中含不饱和烃 | 铁钉发生吸氧腐蚀 | 浓硫酸具有吸水性和强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F筒称PETA,可利用于新型的普适无卤阻燃体系。图是以A为原料合成聚合物F的路线:
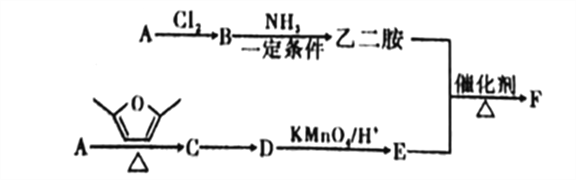
已知: ①A为与氢气的相对密度是14的烃;
②![]() ;
;
③D、E均为芳香化合物,它们的核磁共振氢谱显示均为2组峰。
回答下列问题:
(1)A中的官能团名称为_______,B的名称是______。
(2)B与NH3在一定条件的反应类型为___________。
(3)C的结构简式为___________。
(4)由C转化为D的反应中,除D外,另外一种生成物是___________。
(5)乙二胺和E反应生成聚合物F的化学方程式为___________,反应类型为___________。
(6)E的同分异构体中,满足以下条件的共有_____种(不含立体异构)。
①遇到FeCl3溶液会显色;②能发生银镜反应;③能与NaHCO3溶液反应。
(7)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备![]() 的合成路线:_____________________________。
的合成路线:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式:____________________,反应后得到的溶液呈________色。用此溶液分别做如下实验:
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈________色,停止加热,即制得Fe(OH)3胶体。
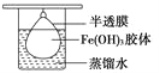
(3)将制得的胶体放入半透膜制成的袋内,如图所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象,这个实验可以用来区别___________________;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为___________________________________________
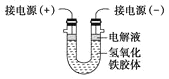
(4)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com