
【题目】恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 (g)+ O2(g) ![]() 2SO3(g),下列不能用来判断该反应达到平衡状态的是
2SO3(g),下列不能用来判断该反应达到平衡状态的是
A. 容器中压强不再变化 B. SO2的体积分数不再变化
C. 容器中混合物的密度不再变化 D. 容器中各物质的浓度不再变化
科目:高中化学 来源: 题型:
【题目】向氧化铁、氧化铜、铁、铜的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示说法不正确的是( )
![]()
![]()
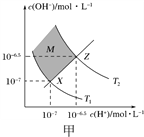
A. 图甲表示水中c(H+)和c(OH-)的关系,则XZ线上任意点均表示溶液呈中性
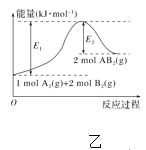
B. 图乙表示由2 mol A(g)和4 mol B(g)形成4 mol A—B键放出E2 kJ能量
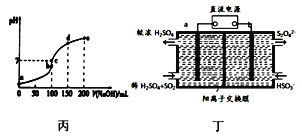
C. 25℃时向l00mL0.1mol/L NH4HSO4溶液中滴加0.lmol/L NaOH溶液的pH与NaOH溶液体积关系曲线如图丙,则a点到b点过程中,溶液导电能力增强
D. 图丁装置(电极均为惰性电极)可吸收SO2,其阴极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.摩尔既是物质的数量单位又是物质的质量单位
B.物质的量是国际单位制中七个基本单位之一
C.阿伏加德罗常数是0.012kg 12C中含有的碳原子数目
D.标准状况下,1molH2O所占的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
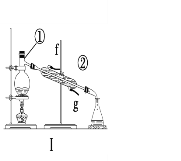
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
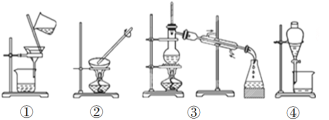
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是
A. 简单离子半径:Y<Z
B. W元素的氧化物对应的水化物可能是弱电解质
C. X2Y2加入酸性高锰酸钾溶液中,还原产物为X2Y
D. X、Z都能分别与Y形成含非极性键的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料。
(1)不同温度、压强下.合破氦平衡休系NH3的物质的量分数如图(N2和H2的起始物质的量之比为1:3)。
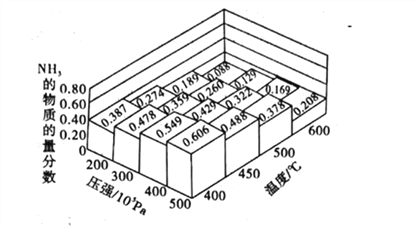
①分析图中数据,升商温度,该反应的平衡常数K值____(填“增大”“城小”或“不变”)。
②下列关于合成氨的说法正确是_____(填序号)。
A.工业上合成氨,为了提高氨的含量压强越大越好
B.使用催化剂可以提高氨气的产率
C.合成氨反应△H<0、△S<0,该反应高温条件下一定能自发进行
D.减小n(N2):n(H2)的比值,有利于提高N2的转化率
③如果开始时向密闭容器中投入1.0molN2和3.0molH2,则在500C、3×107Pa条件下达到平衡时N2的平衡转化率=_______。(保留两位有效数字)
(2)以氨气代替氢气研发氨燃料电池是当前科研的一一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I:NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II:NH2Cl(aq)+HClO(aq)=NHCl(aq)v △H2=bkJ/mol;
反应III:2NHCl2(aq)+H2O(l)=N2(g)+HClO(aq)+3HCl(aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H=________kJ/mol
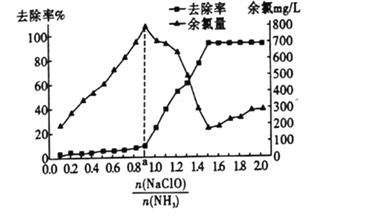
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I
③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
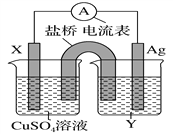
(1)电极X的材料是______;电解质溶液Y是________。
(2)银电极为电池的______极,发生的电极反应式为_______________;X电极上发生的电极反应式为_________________。
(3)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。则电极a为电解池的_______极,b电极附近出现的现象为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝有多重优良性能,因而有极为广泛的用途。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3,等杂质)为原料制备铝的一种工艺流程如图所示
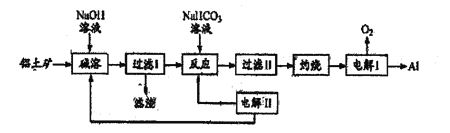
下列说法不正确的是
A. “电解Ⅰ”的电解过程中作阳极的石墨易消耗
B. “电解Ⅱ”阴极区溶液pH变大
C. 理论上每生成1molAl,会有0.75molO2产生
D. “电解Ⅱ”阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com