
【题目】下列实验、现象及有关结论不正确的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | 加热铝箔,铝箔熔化却不滴落 | 石蜡油分解产生的气体能使试管中溴的四氯化碳溶液褪色 | 食盐水浸泡过的铁钉放入试管中,一段时间后,导管口形成一段水柱 | 向蔗糖中加人浓硫酸时,蔗糖变黑,体积膨胀 |
结论 | 氧化铝的熔点比铝的高 | 石蜡油的分解产物中含不饱和烃 | 铁钉发生吸氧腐蚀 | 浓硫酸具有吸水性和强氧化性 |
A. A B. B C. C D. D
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
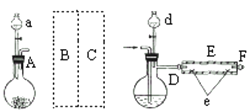
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________,NaHSO3溶液中的各离子浓度由大到小的顺序为________________。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,1体积X2(气)和3体积Y2(气)化合成2体积的气体化合物,则该气体化合物的化合式为( )
A.XY3
B.XY
C.X3Y
D.X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是
A. 简单离子半径:Y<Z
B. W元素的氧化物对应的水化物可能是弱电解质
C. X2Y2加入酸性高锰酸钾溶液中,还原产物为X2Y
D. X、Z都能分别与Y形成含非极性键的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下某容积不变的密闭容器中,可逆反应C(s)+H2O(g)![]() CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2 D. 1 mol H—H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.78gNa2O2与足量的H2O反应,转移的电子数为2NA
B.通常条件下,28gCO和N2的混合气体中所含分子数为NA
C.标准状况下,22.4LH2O中含有的原子数为3NA
D.2mol/LCaCl2溶液中,含有Cl-个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及其化合物在生活、生产中有广泛的应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为_____,若有3mol FeS2参加反应,转移__________mol电子。
②FeCl3与氢碘酸反应时可生成棕色物质I2,该反应的离子方程式为_________________。
(2)已知:S2O32-具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2,I2+2S2O32-→2I-+S4O62-则S2O82-、S4O62-、I2氧化性强弱顺序:_________.
(3) 已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
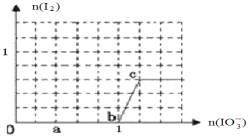
①写出a点处还原产物是_______________;b点到c点反应的离子方程式_________________________。
②当溶液中的I-为0.5 mol时,加入的KIO3为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1 mol·L-1氨水至0.01 mol·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D. c(OH-)
D. c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com