
【题目】室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________,NaHSO3溶液中的各离子浓度由大到小的顺序为________________。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
【答案】 9×108 1.0×10-12 c(Na+)>c(HSO3—)>c(H+)>c(SO32—)>c(OH—) 增大 10
【解析】本题主要考查有关平衡常数的计算。
(1)Ka= 。室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)≈c(CH3COO-)≈
。室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)≈c(CH3COO-)≈![]() = 3×10-3mol/L,由水电离出的c(H+)= c(OH-)=
= 3×10-3mol/L,由水电离出的c(H+)= c(OH-)=![]() =
=![]() mol/L =
mol/L =![]() ×10-8mol/L,醋酸电离出的c(H+) 约是由水电离出的c(H+)的(3×10-3)/(
×10-8mol/L,醋酸电离出的c(H+) 约是由水电离出的c(H+)的(3×10-3)/( ![]() ×10-8)=9×10-8倍。
×10-8)=9×10-8倍。
(2)室温时,NaHSO3的水解平衡常数Kh=Kw /Kal=(1.0×10-14)/( 1.0×10-2)= 1.0×10-12< Kal,HSO3-的电离程度大于水解程度,NaHSO3溶液中存在的变化:H2O![]() H++OH-,
H++OH-,![]()
![]() H+ +
H+ +![]() ,
, ![]() +H2O
+H2O![]() H2SO3+OH-,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO3—)>c(H+)>c(SO32—)>c(OH—)。若向NaHSO3溶液中加入少量I2,I2+
H2SO3+OH-,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO3—)>c(H+)>c(SO32—)>c(OH—)。若向NaHSO3溶液中加入少量I2,I2+![]() + H2O= 2H++I-+
+ H2O= 2H++I-+![]() ,c(HSO3—)减小,则溶液中c(H2SO3)/c(HSO3-)将增大。
,c(HSO3—)减小,则溶液中c(H2SO3)/c(HSO3-)将增大。
(3)室温时,0.1 mol/L Na2SO3溶液中Na2SO3的水解常数Kh=Kw /Ka2=(1.0×10-14)/( 1.0×10-7)= 1.0×10-7,Kh= ,c(OH-)≈c(
,c(OH-)≈c(![]() )=
)=![]() = 1×10-4mol/L,c(H+)=
= 1×10-4mol/L,c(H+)=  =
=![]() mol/L =1×10-10mol/L ,pH=10。
mol/L =1×10-10mol/L ,pH=10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为( )
A.1:1B.2:1C.3:1D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(CH3COOH)2(g)![]() 2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( )
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( )
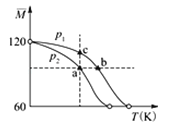
A. 该过程的△H<0
B. 气体压强:p(a)<p(b)= p(c)
C. 平衡常数:K(a)= K(b)< K(c)
D. 测定乙酸的相对分子质量要在高压、低温条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5min后达到平衡,各物质的平衡浓度的关系为:ca(A)c(B)=c(C)c(D)。若在温度不变的情况下将容器的体积扩大为原来的8倍,A的转化率不发生变化,则B的转化率为( )
C(g)+D(g),5min后达到平衡,各物质的平衡浓度的关系为:ca(A)c(B)=c(C)c(D)。若在温度不变的情况下将容器的体积扩大为原来的8倍,A的转化率不发生变化,则B的转化率为( )
A. 60% B. 40% C. 50% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。

试确定A、B、C、D、X各代表何种溶液。
A:________,B:__________,C:_________,D:_________,X:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列操作中,所使用的仪器能够达到目的是( )
A.用5mL量筒准确量取4.55mL水
B.称量4.5g纯碱时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘
C.过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤
D.萃取操作时,选择萃取剂的密度可以比水大也可以比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+ 5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。 某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:
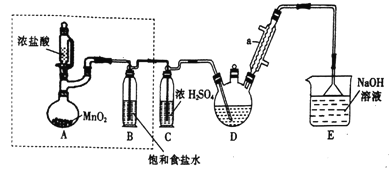
(1)仪器a的名称是______________。
(2)检查虚线框内装置气密性的方法是_________________。
(3)若撤去装置B,对实验的影响是_______________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是_______________________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO- HCOO-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L 碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2SO3溶液20.00mL。滴定时所用指示剂是______,达到滴定终点的现象是_________,测得产品的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、现象及有关结论不正确的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | 加热铝箔,铝箔熔化却不滴落 | 石蜡油分解产生的气体能使试管中溴的四氯化碳溶液褪色 | 食盐水浸泡过的铁钉放入试管中,一段时间后,导管口形成一段水柱 | 向蔗糖中加人浓硫酸时,蔗糖变黑,体积膨胀 |
结论 | 氧化铝的熔点比铝的高 | 石蜡油的分解产物中含不饱和烃 | 铁钉发生吸氧腐蚀 | 浓硫酸具有吸水性和强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备FeCO3的流程如下:

(1)“酸溶”时加快反应速率的方法有______(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:
FeS2+14Fe3++8H2O![]() 15Fe2++2S
15Fe2++2S![]() +16H+,则另一个反应的离子方程式为_________。
+16H+,则另一个反应的离子方程式为_________。
②加入FeS2还原后,检验Fe3+是否反应完全的方法是______________________。
(3)①“沉淀”时,需要控制温度在35 ℃以下,其可能原因是___________________。
②所得FeCO3需充分洗涤,检验沉淀已洗净的方法是______________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_______(填化学式)。
(5)写出在空气中煅烧FeCO3制备高纯氧化铁的化学方程式:_________________。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,则Fe2O3的质量为____kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com