
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是_____________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________________________。
(4)分液漏斗在使用前须清洗干净并_____;在本实验分离过程中,产物应该从分液漏斗的_____(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.接收器 B.温度计 C.吸滤瓶 D.球形冷凝管
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
【答案】直形冷凝管 防止暴沸 B ![]() 检漏 上口倒出 吸收产物中少量的水(或干燥) CD C
检漏 上口倒出 吸收产物中少量的水(或干燥) CD C
【解析】
(1)根据装置图可知装置b的名称;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,分子间还可以发生取代反应;
(4)分液漏斗有活塞和塞子,结合分液漏斗的使用方法解答;根据环己烯的密度比水的密度小分析判断;
(5)根据无水氯化钙具有吸水性分析;
(6)观察题目提供的实验装置图分析判断;
(7)首先计算出20g环己醇的物质的量,根据反应方程式,求出理论上可以得到的环己烯的质量,再根据产率=![]() ×100%计算。
×100%计算。
(1)依据装置图可知,装置b是蒸馏装置中的冷凝器装置,故答案为:直形冷凝管;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故选B,故答案为:防止暴沸;B;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚为![]() ,故答案为:
,故答案为:![]() ;
;
(4)由于分液漏斗有活塞和塞子,使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,应该从分液漏斗的上口倒出,故答案为:检漏;上口倒出;
(5)分离提纯过程中加入无水氯化钙,是利用无水氯化钙吸收产物中少量的水,故答案为:吸收产物中少量的水(或干燥);
(6)观察题目提供的实验装置图知,蒸馏过程中需要用到蒸馏烧瓶、温度计、直形冷凝管、接收器,锥形瓶等,用不到吸滤瓶和球形冷凝器管,故选:CD;
(7)20 g环己醇的物质的量为![]() =0.2mol,理论上可以得到0.2mol环己烯,即理论上得到环己烯的质量为82g/mol×0.2mol=16.4g,所以产率=
=0.2mol,理论上可以得到0.2mol环己烯,即理论上得到环己烯的质量为82g/mol×0.2mol=16.4g,所以产率=![]() ×100%=61%,故选C。
×100%=61%,故选C。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为![]()
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 原子半径大小:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是

A. 气球B中装的是O2B. 气球A和气球D中气体物质的量之比为4:1
C. 气球A和气球C中气体分子数相等D. 气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(填字母,下同)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______(填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______________________。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=_______________(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
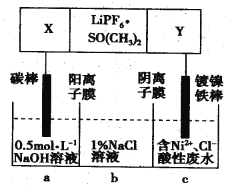
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
(1)蛋白质是人体必需的营养物质,它在人体内最终分解为_______
A.葡萄糖 B.氨基酸 C.脂肪酸
(2)现有下列五种物质:
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素
请按下列要求填空(填序号)。
富含维生素C的是________;可直接进入血液,补充能量的是_______ ;应用最广泛的抗生素之一的是_______;即可作为调味剂,又可作为防腐剂的是_______;食用过多会引起血压升高、肾脏受损的_________。
(3)鸡蛋含有丰富的蛋白质,它在人体内消化过程如下:
![]()
请回答下列问题:
a.向鸡蛋清溶液中滴入几滴浓硝酸,微热,鸡蛋清变为________色。
b.氨基酸具有两性,是因为氨基酸分子中既含有碱性官能团又含有酸性官能团,其中,碱性官能团是____________,酸性官能团是____________。
c.向鸡蛋清溶液中加入饱和Na2SO4溶液,有白色沉淀产生,发生的是_______(填“盐析”或“变性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa。25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法不正确的是

A. a点溶液中:c(HA-)=c(H2A)
B. b点溶液中:A2-水解平衡常数Kh1=10-6.81
C. c点溶液中:V0=30
D. a、b、c、d四点中,d点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= —24.8 kJ·mol-1;3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ·mol-1 ;Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +19.4kJ·mol-1则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为
A. 放出11 kJ B. 放出5.5kJ C. 吸收11 kJ D. 吸收5.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)19 g 某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是________;ACl2的化学式是________。
(2)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是________;同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com