
【题目】(1)19 g 某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是________;ACl2的化学式是________。
(2)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是________;同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
【答案】95 g/mol 24 MgCl2 17:32 32:17 16 6.02×1022
【解析】
(1)计算ACl2的物质的量,根据M=![]() ,计算ACl2的摩尔质量,进而计算A的相对原子质量,判断A为何种元素,书写化学式。
,计算ACl2的摩尔质量,进而计算A的相对原子质量,判断A为何种元素,书写化学式。
(2)根据n=![]() ,n=
,n=![]() ,n=
,n=![]() 结合摩尔质量与物质相对分子质量是关系计算。
结合摩尔质量与物质相对分子质量是关系计算。
(1)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,ACl2的物质的量为0.2mol,则ACl2的摩尔质量为M=![]() =95g/mol,A的相对原子质量为95-35.5×2=24,因此A为Mg元素,该物质的化学式为MgCl2;
=95g/mol,A的相对原子质量为95-35.5×2=24,因此A为Mg元素,该物质的化学式为MgCl2;
(2)由于物质的量n=![]() ,n=
,n=![]() ,可知在同温同压下,同体积的气体的物质的量相等,则气体的质量比等于气体的摩尔质量的比,故m(NH3):m(O2)=17:32;
,可知在同温同压下,同体积的气体的物质的量相等,则气体的质量比等于气体的摩尔质量的比,故m(NH3):m(O2)=17:32;
若氨气与氧气的质量相等,根据n=![]() 可知气体的物质的量与气体的摩尔质量成反比,则n(NH3):n(O2)=
可知气体的物质的量与气体的摩尔质量成反比,则n(NH3):n(O2)=![]() ,根据n=
,根据n=![]() 可知气体的体积比等于气体的物质的量的比,所以V(NH3):V(O2)= n(NH3):n(O2)=32:17;
可知气体的体积比等于气体的物质的量的比,所以V(NH3):V(O2)= n(NH3):n(O2)=32:17;
在同温同压下,相同体积的任何气体的物质的量相同,则根据n=![]() 可得
可得![]() ,则M(A)=16g/mol,所以气体A的相对分子质量为16;
,则M(A)=16g/mol,所以气体A的相对分子质量为16;
n(A)=n(H2)=![]() =0.1mol,所以N(A)=nNA=0.1mol×6.02×1023/mol=6.02×1022。
=0.1mol,所以N(A)=nNA=0.1mol×6.02×1023/mol=6.02×1022。


科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是_____________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________________________。
(4)分液漏斗在使用前须清洗干净并_____;在本实验分离过程中,产物应该从分液漏斗的_____(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.接收器 B.温度计 C.吸滤瓶 D.球形冷凝管
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.二氧化氯是高效、低毒的消毒剂。已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如下图所示。回答下列问题:
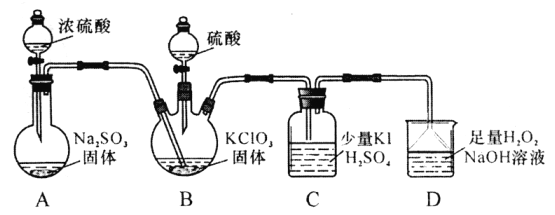
(1)置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___________。装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。淀粉的作用是___________。
(2)C装置的导管靠近而不接触液面,其目的是_________________________________。
(3)用ClO2消毒自来水,其效果是同质量氯气的___________倍(保留一位小数)
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2︰1,则还原产物的化学式是___________。
(5)若将C裝置中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:CO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:_________________________________。
②请设计实验证明你的假设(仅用离子方程式表示):______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有①6.72 L CO2 ②6.02×1023个HCl分子 ③0.1mol NH3 ④4g氢气,请回答:
(1)它们的体积由大到小的顺序为___________________(填写序号,下同);
(2)质量由大到小的顺序为______________________,
(3)密度由大到小的顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设氯原子的质量为 a g, 12C 原子的质量为b g, 用 NA 表示阿伏加德罗常数的值, 则下列说法正确的是( )
A.氯元素的相对原子质量为12/b
B.m g 该氯原子的物质的量为 m/NA mol
C.该氯原子的摩尔质量是a NA
D.n g 该氯原子所含的电子数是17n/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应,同时获得副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
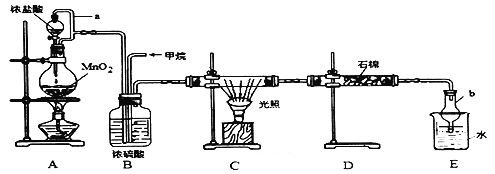
根据要求填空:
(1)A装置发生反应的离子方程式是_________________________________。C装置中CH4与Cl2生成一氯代物的化学反应方程式是___________________________ 。
(2)导管a的作用是____________。仪器b的名称是____________。
(3)D装置中的石棉上均匀附着潮湿的KI,其作用是______________ 。
(4)E装置中除了有盐酸生成外,还含有有机物。从E中分离出盐酸的最佳方法为__________E装置的作用是____________。(填序号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)该装置的缺陷是没有进行尾气处理,其尾气的主要成分是_______.
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
(6)在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图:
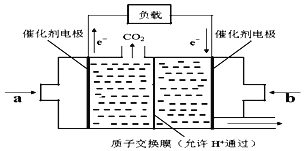
若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表

回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有______________________(任写两种)。
(2)气体X的电子式为___________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________。
(3)加入H2O2的目的是___________;若将上述过程中的“H2O2”用“ NaClO”代替也能达到同样目的,则发生反应的离子方程式为_________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过______________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000g氯化镁晶体产品于250mL锥形瓶中,加水50mL使其完全溶解,加入100mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断震荡下,用0.5000mol·L-1的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4-=MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00mL。
①则产品中MgCl2·6H2O的质量分数为___________(结果保留3位有效数字)。
②下列滴定操作会导致测量结果偏高的是___________(填宇母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数 d滴定管滴定前有气泡,滴定后气泡消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com