
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g) ![]() P4O10(s) ΔH1=2 983.2 kJ·mol1
P4O10(s) ΔH1=2 983.2 kJ·mol1
P(s,红磷)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH2=738.5 kJ·mol1
P4O10(s) ΔH2=738.5 kJ·mol1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g) ![]() P4O6(s) ΔH= 1 638 kJ·mol1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
P4O6(s) ΔH= 1 638 kJ·mol1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g) ![]() 4PCl3(s)的反应热ΔH= 。
4PCl3(s)的反应热ΔH= 。
【答案】(1)P4(s,白磷) ![]() 4P(s,红磷) ΔH=29.2 kJ·mol1
4P(s,红磷) ΔH=29.2 kJ·mol1
(2)3∶1 1 323.45 kJ
(3)1 326 kJ·mol1
【解析】(1)根据盖斯定律,由第一个反应第二个反应×4,可得:P4(s,白磷) ![]() 4P(s,红磷) ΔH=2 983.2 kJ·mol1(738.5 kJ·mol1)×4=29.2 kJ·mol1。
4P(s,红磷) ΔH=2 983.2 kJ·mol1(738.5 kJ·mol1)×4=29.2 kJ·mol1。
(2)n(白磷)= ![]() =0.5(mol),n(O2)=
=0.5(mol),n(O2)= ![]() =2.25(mol),设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol1×0.375 mol+ 1638 kJ·mol1×0.125 mol=1 323.45 kJ。
=2.25(mol),设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol1×0.375 mol+ 1638 kJ·mol1×0.125 mol=1 323.45 kJ。
(3)根据图示,1分子P4、PCl3中分别含有6个P—P键、3个P—Cl键,反应热为断裂6 mol P—P键、6 mol Cl—Cl键吸收的能量和形成12 mol P—Cl键放出的能量之差,即ΔH=(6×198 kJ·mol1+6×243 kJ·mol1)
12×331 kJ·mol1=1 326 kJ·mol1。
【备注】解答本题时,第(2)问的关键是根据原子守恒确定反应产物,第(3)问的关键是分析P4和PCl3分子中的化学键情况。


科目:高中化学 来源: 题型:
【题目】1997年,第一只“克隆羊”在英国诞生,“克隆羊”的关键技术之一是找到一些特殊的酶,它们能激活普通体细胞,使之像生殖细胞一样发育成个体。下列有关酶的叙述错误的是
A.酶是具有催化功能的蛋白质
B.酶的催化作用具有选择性和专一性
C.酶通常在强酸或强碱条件下发挥作用
D.高温或紫外线照射会降低酶的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B两种气体在一定条件下可以发生反应:2A+B![]() C+3D,现将2 mol A气体与1 mol B气体充入一个密闭容器中,温度和压强恒定的情况下,测得反应后气体体积为反应前的一半,且测得放出的热量为198 kJ,则下列热化学方程式可能正确的是( )
C+3D,现将2 mol A气体与1 mol B气体充入一个密闭容器中,温度和压强恒定的情况下,测得反应后气体体积为反应前的一半,且测得放出的热量为198 kJ,则下列热化学方程式可能正确的是( )
A. 2A(g)+B(g) ![]() C(g)+3D(g) ΔH=-198kJ·mol-1
C(g)+3D(g) ΔH=-198kJ·mol-1
B. C(g)+3D(l) ![]() 2A(g)+B(g) ΔH=+198kJ·mol-1
2A(g)+B(g) ΔH=+198kJ·mol-1
C. 2A(g)+B(g) ![]() C(g)+3D(l) ΔH=-198kJ·mol-1
C(g)+3D(l) ΔH=-198kJ·mol-1
D. C(g)+3D(l) ![]() 2A(g)+B(g) ΔH=+264kJ·mol-1
2A(g)+B(g) ΔH=+264kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
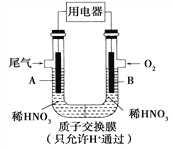
A. 电解质溶液中电流的方向由B到A,电子的流向与之相反
B. 电极A表面反应之一为NO-3e-+2H2O===NO![]() +4H+
+4H+
C. 电极B附近的c(NO![]() )增大
)增大
D. 该电池工作时,每转移4 mol电子,生成22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学键及化合物的分类完全正确的一组是
A. MgCl2与NaOH均既含离子键又含共价键,均属离子化合物
B. BaCO3与H2SO4化学键类型不完全相同,均属强电解质
C. 乙醇与醋酸,均只含共价键,均属非电解质
D. 氯气与氧气,均只含共价键,均只做氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在配制氯化铁溶液时,先把氯化铁晶体溶解在稀盐酸中,再加水稀释所需浓度,如此操作的目的是
A.防止氯化铁电离B.抑制氯化铁水解
C.提高溶液的pHD.提高氯化铁的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制2.0 mol/L的NaOH溶液480 mL:

(1)配制时,必须使用的玻璃仪器有烧杯、胶头滴管、_____________、______________。
(2)要完成本实验该同学应称出NaOH ____________ g
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为_____________g
(4)使用容量瓶前必须进行的一步操作是__________________
(5)在配制过程中其他操作都是正确的,下列操作会引起误差偏高的是___________。
A.没有洗涤烧杯和玻璃棒
B.未冷却到室温就将溶液转移到容量瓶并定容
C.容量瓶不干燥,含有少量蒸馏水
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com