
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
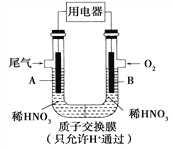
A. 电解质溶液中电流的方向由B到A,电子的流向与之相反
B. 电极A表面反应之一为NO-3e-+2H2O===NO![]() +4H+
+4H+
C. 电极B附近的c(NO![]() )增大
)增大
D. 该电池工作时,每转移4 mol电子,生成22.4 L O2
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】把下列4种溶液,分别加入到4支装有形状大小相同的锌粒的试管中充分反应,其中产生H2的速率最大的是 ( )
A. 40 mL,5 mol·L-1的盐酸
B. 60 mL,6 mol·L-1的硝酸
C. 15 mL,4 mol·L-1的硫酸
D. 40mL,18 mol·L-1的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。

(1)仪器a的名称是__________________。
(2)干燥管C内盛放的药品是___________________。
(3)装置D中的现象是_________________________。
(4)写出铁在高温下与水蒸气反应的化学方程式:_________________________。
(5)当装置B的玻璃管中固体的质量增加16g时,生成H2在标准状况下的体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氯气②二氧化硫③活性炭④漂白粉,都能使品红溶液褪色,但褪色过程不发生氧化还原反应的是( )
A. ①② B. ②③ C. ①④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支50 mL酸式滴定管,其中盛有溶液,液面恰好在10.0 mL刻度处,把滴定管中的溶液全部流下排出,盛接在量筒中,量筒内溶液的体积
A.大于40.0 mLB.为40.0 mLC.小于40.0 mLD.为10.0 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g) ![]() P4O10(s) ΔH1=2 983.2 kJ·mol1
P4O10(s) ΔH1=2 983.2 kJ·mol1
P(s,红磷)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH2=738.5 kJ·mol1
P4O10(s) ΔH2=738.5 kJ·mol1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g) ![]() P4O6(s) ΔH= 1 638 kJ·mol1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
P4O6(s) ΔH= 1 638 kJ·mol1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g) ![]() 4PCl3(s)的反应热ΔH= 。
4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知盐酸是强酸,在下列叙述中,能说明醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入水的量少
B.盐酸和醋酸都可用相应的钠盐与同浓度硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32g红棕色固体.根据题意下列结论不正确的是( )
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0molL﹣1 400mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com