
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:分析 (1)根据电池反应式知,失电子化合价升高的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的化合价降低的可溶性反应物作电解质溶液,据此设计原电池;
(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;
(3)电子从负极沿导线流向正极;
(4)n(Cu)=$\frac{1.6g}{64g/mol}$=0.025mol,则失去0.05mol电子,由Ag++e=Ag可知,生成0.05molAg,若X和银不用导线连接,铜与银发生置换反应;
(5)原电池反应必须是自发进行的放热的氧化还原反应.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,所以X电极材料是Cu,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3 ;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,铜发生氧化反应,
故答案为:正极; Ag++e-=Ag;氧化反应;
(3)电子从负极Cu沿导线流向正极Ag,故答案为:Cu;Ag;
(4)n(Cu)=$\frac{1.6g}{64g/mol}$=0.025mol,则失去0.05mol电子,由Ag++e=Ag可知,生成0.05molAg,若X和银不用导线连接,铜与银发生置换反应,所以铜棒增重,增重为5.4g-1.6g=3.8g,则m(Ag)=0.05mol×108g/mol=5.4g,
故答案为:5.4g;铜;3.8g;
(5)原电池反应必须是自发进行的放热的氧化还原反应,该反应是吸热反应且不是氧化还原反应,所以不能设计成原电池,故答案为:否.
点评 本题考查了原电池设计,明确原电池原理是解本题关键,根据电池反应式中得失电子的物质选取负极材料和电解质,知道原电池中正负极的判断方法,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
 为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答:
为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Fe | Fe | Cu | Cu |
| 负极 | Cu | Cu | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 496 kJ•mol-1 | B. | 431 kJ•mol-1 | C. | 862 kJ•mol-1 | D. | 248 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
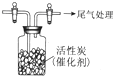 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 键 | N-H | N-N | O=O | N≡N | H-O |
| 键能/kJ•mol-1 | 391 | 193 | 497 | 946 | 463 |
| A. | 1088 kJ•mol-1 | B. | 544 kJ•mol-1 | C. | 790 kJ•mol-1 | D. | 382 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 C的离子结构示意图:
C的离子结构示意图: .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com