
【题目】实验室用大理石和盐酸制备CO2。下列措施可使反应速率加快的是
A.粉碎大理石B.延长反应时间C.降低反应温度D.加水稀释盐酸
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)十3c(HCO3-)+3c(H2CO3)
C. 0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D. 0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q、m、n分别为常见的气体单质,p和s均为有色气体,q能在p中燃烧并产生苍白色火焰,v的水溶液呈碱性,t的水溶液呈酸性。回答下列问题:
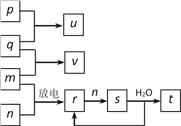
(1)新制p的水溶液中,除H2O、H+、OH-外,还含有____________等粒子(填化学式),该溶液中发生反应的离子方程式是___________。
(2)取2份新制p的水溶液,向第一份中滴入紫色石蕊溶液,现象是____________;第二份先滴入FeCl2溶液,后加入KSCN溶液,其现象是_____________,有关反应的离子方程式为_______________、_________________。
(3)反应“v+n→r”的化学方程式是__________,每转移2 mol电子,可生成标准状况下的r气体________L。s溶于水的反应中,氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 碳酸氢钠的水解:HCO3-+ H2O![]() H3O++ CO32-
H3O++ CO32-
B. 以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:Al3+ +3HCO3-=Al(OH)3↓+3CO2↑
C. 1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液:Al3++4OH— = AlO2-+2H2O
D. 用惰性电极电解AlCl3溶液:2Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,可能是KCl、NaBr、KI.向甲中加入淀粉溶液和氯水,溶液变为橙色,再加入丙,颜色无明显变化,则甲、乙、丙依次含有( )
A.NaBr、KCl、KI
B.NaBr、KI、KCl
C.KI、NaBr、KCl
D.KCl、KI、NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
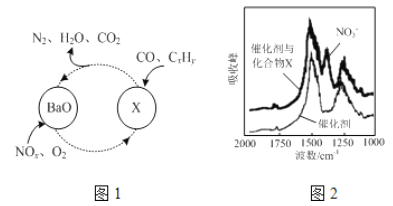
①在图示的转化中,被还原的元素是_______________,X的化学式为__________________。
②钡元素在周期表中的位置是___________________________。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的最之比为2:1时,写出发生反应的化学方程式:____________________________。
(3)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
(4)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①检验废水中是否存在NH4+的方法是_______________________________________________。
②若处理废水产生了0.448LN2 (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是![]() 、
、![]() 、Cl、
、Cl、![]() 中的一种。(离子在物质中不重复出现)
中的一种。(离子在物质中不重复出现)
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断:
(1)A的化学式为____________,B的化学式为____________。
(2)写出少量盐酸与D反应的离子方程式:____________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:________________________。
(4)C溶液中阴离子的检验方法是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1;将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s) +5H2O(
CuSO4(s) +5H2O(![]() ),热效应为ΔH3。则下列判断正确的是
),热效应为ΔH3。则下列判断正确的是
A. ΔH2>ΔH3 B. ΔH1<ΔH3
C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2=ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com