
【题目】几种短周期元素的主要化合价及原子的原子半径数据见下表:

据表中信息判断。下列有关叙述中,正确的是
A.M与T形成的化合物能和强酸、强碱反应且产物不同
B.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
C.Q、T两元素的氢化物热稳定性比较: Q的氢化物大于T的氢化物
D.L与T形成的二元化合物,溶于水生成强碱
【答案】A
【解析】
根据表格中的化合价,可以推断出L、M、Q、R、T最外层电子数为2、3、6、7、6。由原子半径的数据可知,L、M、Q、R为同周期元素,所有元素都在短周期,可以推断L、M、Q、R都在第三周期,分别为Mg、Al、S、Cl,T在第二周期,为O元素。
A.Al与O形成的化合物Al2O3为两性氧化物能和强酸强碱反应,前者生成Al3+,后者生成AlO2-,产物不同,A正确;
B.根据元素周期律,Mg比Al活泼,Mg、Al的单质分别与同浓度的稀盐酸反应时, Mg的单质反应更剧烈,B错误;
C.S、O两元素的非金属性:S<O ,非金属性越弱,气态氢化物的稳定性越弱,故稳定性H2S<H2O,C错误;
D.Mg和O元素形成的二元化台物为MgO,难溶于水,也不与水反应, D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________.
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol KClO3放出热量38.8kJ,在存在MnO2条件下加热,KClO3的分解机理为:
①2KClO3+4MnO2=2KCl+2Mn2O7 慢 ②2Mn2O7=4MnO2+3O2 快
下列有关说法中不正确的是( )
A. 1mol KClO3所具有的总能量高于1mol KCl和1.5mol O2所具有的总能量
B. KClO3分解速率快慢主要取决于反应①
C. 1g KClO3、1g MnO2和0.1g Mn2O7混合加热,充分反应后MnO2质量为1g
D. 将固体二氧化锰碾碎,可加快KClO3的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。有关该电池的说法正确的是( )

A. 通入氧气的电极为负极
B. 电池工作时,溶液中的Na+由负极移向正极
C. 负极的电极反应为Mg-2e-+2OH-=Mg(OH)2
D. 当电路中转移0.04 mol电子时,参加反应的O2为体积224ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,可用于检测酒驾中酒精的含量,电化学制备K2Cr2O7的装置如图所示,其中a、b均为石墨电极。下列说法正确的是

A. X是电源的正极
B. 电解过程中K+向b极移动
C. b极上发生的电极反应为:2CrO42-+2H+=Cr2O72-+H2O
D. 理论上a、b两电极放出的气体的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________________。
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
b. ![]() △H2
△H2
已知H2(g)+ ![]() O2(g)
O2(g) ![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
则反应②的△H2=_________ kJ·mol-1。
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。
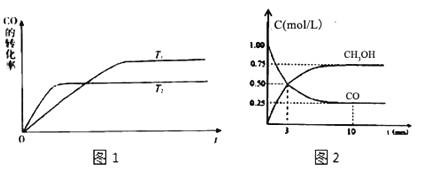
①该反应的焓变△H_____0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1_____K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=_____,该反应的平衡常数为K=_____。
④恒容条件下,达到平衡后,下列措施中能使![]() 增大的有_____。
增大的有_____。
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O64-。试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少______。
(2)滴定操作时,左手控制滴定管,右手_______,眼睛要注视________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由_______色变为_______色。
(4)水中溶解氧的计算式是___(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果____(填“偏高”、“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定的误差要求小于0.1%,若用20.00 mL0.2000mol·L-1盐酸滴定20mL0.2000mol·L-1NaOH溶液,则中和滴定曲线中发生突变时的pH范围是(lg2=0.3)( )
A. 4.3~9.7B. 3.7~10.3C. 4.0~10.0D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com