
【题目】芬太尼(结构式如图)是一种强效的类阿片止痛剂,起效迅速而作用时间极短。当它与药物联合使用时,通常用作疼痛药物或麻醉剂。下列说法正确的是

A. 它的分子式是C22H27N2O B. 它和苯是同系物
C. 它属于烃的衍生物 D. 药物可以过量使用
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定H2C2O4溶液,当_________________时,滴定结束。
④记录数据,重复实验。整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)步骤①需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为______(填名称)。
(2)该反应原理的化学方程式为_________________;
(3)请将步骤③补充完整__________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______________mol/L,x=____________;
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会__________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法不正确的是( )

A.燃料电池工作时,正极反应为O2+4H++4e﹣=2H2O
B.a极是铜,b极是铁时,可实现铁上镀铜
C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出的铜质量相等
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图。根据题意回答问题:
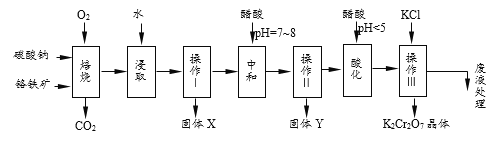
已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
③Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(2)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。酸化步骤用醋酸调节溶液pH<5,其目的是________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、_______、过滤、_______、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
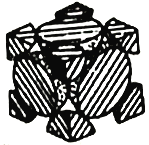
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应:2A(s)+2B(g)![]() C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
A.混和气体的平均相对分子质量不再改变
B.混和气体的密度不随时间而变化
C.容器内的压强不随时间而变化
D.A的质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子—M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) △H2=-0.92 kJ/mol
(2)O2(g)=O2(l) △H2=-6.84 kJ/mol
(3)如图:下列说法正确的是( )
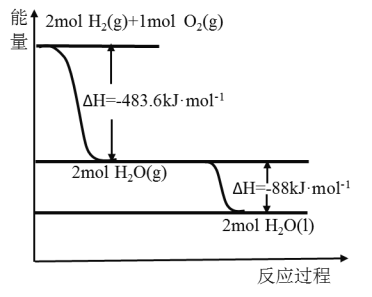
A.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) △H=-474.92 kJ/mol
B.氢气的燃烧热为△H=-241.8 kJ/mol
C.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行中和热的测定实验,分别取50 mL 0.55 mol/L的NaOH溶液、50 mL 0.25 mol/L的硫酸进行实验,回答下列问题:
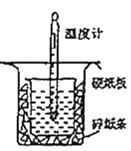
(1)从图中实验装置看,其中尚缺少的用品是_______,除此之外,装置中的一个明显错误是_______。
(2)近似认为0.55 mol/L的NaOH溶液和0.25 mol/L的硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以下数据计算中和热△H=_________。(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用50 mL0.25 mol/L的H2SO4和50 mL0.55 mol/L的NH2·H2O溶液进行反应,与上述实验相比,所放出的热量_______(填“不变”“偏高"或“偏低”)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是________(填字母)。
a. 实验装置保温、隔热效果差
b. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 将以上四实验测量温度均纳入计算平均值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com