
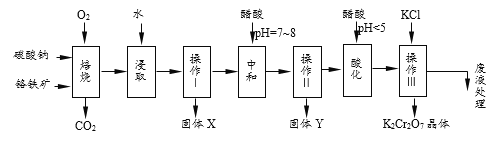
【题目】(1)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图。根据题意回答问题:
已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
③Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(2)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。酸化步骤用醋酸调节溶液pH<5,其目的是________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、_______、过滤、_______、干燥。
【答案】Fe2O3、MgO pH计 增大溶液中c(H+),使平衡逆向移动,产生更多的Cr2O72- 冷却结晶 洗涤
【解析】
铬铁矿通过焙烧,发生的反应有4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑、Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2↑、Na2CO3+Al2O3![]() 2NaAlO2+CO2↑,所以得到的固体中含有Na2CrO4、Fe2O3、MgO和NaAlO2,然后加水溶解得固体中含有Fe2O3、MgO和溶液中含有Na2CrO4、NaAlO2,检测酸化操作中溶液的pH是否等于4.5应该使用pH计;调节溶液的pH为小于5,目的是使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,然后将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到K2Cr2O7晶体。
2NaAlO2+CO2↑,所以得到的固体中含有Na2CrO4、Fe2O3、MgO和NaAlO2,然后加水溶解得固体中含有Fe2O3、MgO和溶液中含有Na2CrO4、NaAlO2,检测酸化操作中溶液的pH是否等于4.5应该使用pH计;调节溶液的pH为小于5,目的是使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,然后将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到K2Cr2O7晶体。
(2)通过上述分析可知得到的固体X含有Fe2O3、MgO;
要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计;
在溶液中存在化学平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,向滤液中加入醋酸并调节溶液的pH <5,增大了溶液中c(H+),H+是生成物,增大生成物的浓度,平衡逆向移动,产生更多的Cr2O72-,使溶液中c(Cr2O72-)增大,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7;
2CrO42-+2H+,向滤液中加入醋酸并调节溶液的pH <5,增大了溶液中c(H+),H+是生成物,增大生成物的浓度,平衡逆向移动,产生更多的Cr2O72-,使溶液中c(Cr2O72-)增大,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1) 室温下,测得 0.1 mol·L1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式_______。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
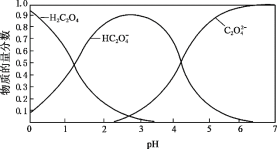
① 向草酸溶液中滴加KOH溶液至pH = 2.5时发生的主要反应的离子方程式是_______。
② 0.1 mol·L1 KHC2O4溶液中,下列粒子浓度关系正确的是_______(填序号)。
a.c(K+) + c(H+) = c(HC2O4–) + c(C2O42–) + c(OH–)
b.c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4)
c.c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+
① 制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_____。
② 测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+则FeC2O4·xH2O中x = _______(FeC2O4的摩尔质量是144 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子组成为CxHy的烷烃、烯烃、炔烃的说法中不正确的是( )
A.当x≤4时,常温常压下均为气体
B.y一定为偶数
C.燃烧1mol CxHy时,消耗氧气(x+![]() )mol
)mol
D.在密团容器中完全燃烧,150℃时测得的压强一定比燃烧前的增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解200mLH2SO4和CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),原混合溶液中Cu2+的物质的量浓度为( )
A.0.2mol·L-1B.0.3mol·L-1C.0.4mol·L-1D.0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
![]() 该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
![]() 应该选用的仪器及装置有
应该选用的仪器及装置有![]() 填字母
填字母![]() ______ .
______ .
![]() 生石灰与氯化铵反应生成氨气的化学方程式为 ______ .
生石灰与氯化铵反应生成氨气的化学方程式为 ______ .
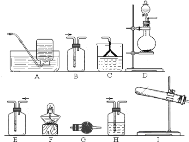
![]() 该小组同学设计如图所示装置探究氨气的还原性.
该小组同学设计如图所示装置探究氨气的还原性.

在上述过程会同时发生多个反应,写出其中属于置换反应的化学方程式 ______ ![]() 若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ______ .
若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ______ .
![]() 该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
![]() 甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是 ______
甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是 ______ ![]() 填“甲”或“乙”
填“甲”或“乙”![]() ,原因是 ______ .
,原因是 ______ .
![]() 检验产物中有
检验产物中有![]() 的方法为 ______ .
的方法为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);
(2)100 ℃时,体系中各物质浓度随时间变化如图所示。
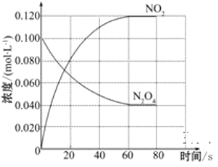
在0~60 s时段,反应速率v(N2O4)为___________________mol·L-1·s-1;反应的平衡常数K的数值为_________________________(保留两位小数)。
(3)100 ℃时,反应达平衡后,将反应容器的容积减少一半。平衡向________(填“正反应”或“逆反应”)方向移动。
(4)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T________100 ℃(填“大于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬太尼(结构式如图)是一种强效的类阿片止痛剂,起效迅速而作用时间极短。当它与药物联合使用时,通常用作疼痛药物或麻醉剂。下列说法正确的是

A. 它的分子式是C22H27N2O B. 它和苯是同系物
C. 它属于烃的衍生物 D. 药物可以过量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的方程式书写不正确的是
A.0.1 mol/L氨水的pH约为11.1:NH3·H2O![]() NH4+ + OH-
NH4+ + OH-
B.用明矾[KAl(SO4)2·12H2O]作净水剂:Al3++ 3H2O ![]() Al(OH)3 (胶体) + 3H+
Al(OH)3 (胶体) + 3H+
C.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72-(橙色) + H2O ![]() 2CrO42-(黄色) +2H+
2CrO42-(黄色) +2H+
D.用饱和Na2CO3溶液处理水垢中的CaSO4:Ca2++ CO32=CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60可用作储存氢气的材料,结构如右图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是
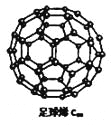
A.C60、Si60、N60都属于原子晶体
B.C60、Si60、N60分子内共用电子对数目相同
C.由于![]() 键能小于
键能小于![]() ,故N60的稳定性弱于N2
,故N60的稳定性弱于N2
D.由于![]() 键长小于
键长小于![]() 键,所以C60熔、沸点低于Si60
键,所以C60熔、沸点低于Si60
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com