
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1) 室温下,测得 0.1 mol·L1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式_______。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
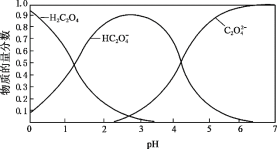
① 向草酸溶液中滴加KOH溶液至pH = 2.5时发生的主要反应的离子方程式是_______。
② 0.1 mol·L1 KHC2O4溶液中,下列粒子浓度关系正确的是_______(填序号)。
a.c(K+) + c(H+) = c(HC2O4–) + c(C2O42–) + c(OH–)
b.c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4)
c.c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+
① 制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_____。
② 测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+则FeC2O4·xH2O中x = _______(FeC2O4的摩尔质量是144 g·mol-1)。
【答案】H2C2O4 H+ + HC2O4-,HC2O4- C2O42- + H+ ![]() bc NH3·H2O 与H+反应,降低c(H+)浓度,使Fe2++ H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+ 平衡向正反应方向移动,产生更多的FeC2O4·xH2O 2
bc NH3·H2O 与H+反应,降低c(H+)浓度,使Fe2++ H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+ 平衡向正反应方向移动,产生更多的FeC2O4·xH2O 2
【解析】
(1)测得 0.1 mol·L1 H2C2O4溶液的pH=1.3,说明草酸是二元弱酸;
(2)①向草酸溶液中滴加KOH溶液至pH=2.5,图像可以看出,随着氢氧化钾的加入,HC2O4-的浓度逐渐增大,草酸与氢氧化钾反应后生成HC2O4-和水;
② a. 根据电荷守恒判断;
b.根据溶液中离子的电离和水解情况分析;
c.根据物料守恒判断;
(3)①应用勒夏特列原理,根据离子方程式:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+,滴加NH3·H2O 与H+反应,降低c(H+)浓度,使平衡向正反应方向移动,产生更多的FeC2O4·xH2O;
②根据10FeC2O4xH2O+6KMnO4+4H2SO4═5Fe2(SO4)3+2CO2↑+6MnSO4+3K2SO4+(12+x)H2O可知,n(FeC2O4xH2O)=![]() n(KMnO4)=
n(KMnO4)=![]() ×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=
×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=![]() =180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180计算出x即可;
=180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180计算出x即可;
(1)二元弱酸分步电离,草酸电离方程式为:H2C2O4 H++HC2O4-,HC2O4-C2O42- +H+,
故答案为:H2C2O4 H+ + HC2O4-,HC2O4- C2O42- + H+;
(2) a. 溶液中有的离子:HC2O4-、H2C2O4、C2O42-、OH–、K+,根据电荷守恒c(K+) + c(H+) = c(HC2O4–) +2c(C2O42–) + c(OH–),故a错误;
b. KHC2O4溶液中,HC2O4–要水解,c(K+) > c(HC2O4–) ,C2O42–是由HC2O4–电离后得到的,c(HC2O4–) > c(C2O42–),H2C2O4是由HC2O4–水解后得到的,HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度,可以得到c(C2O42–) > c(H2C2O4),c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4),故b正确;
c. 根据物料守恒,可得到c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4),故c正确;
故答案为b,c;
(3)①应用勒夏特列原理,根据离子方程式:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+,滴加NH3·H2O与H+反应,降低c(H+)浓度,使平衡向正反应方向移动,产生更多的FeC2O4·xH2O,
故答案为:NH3·H2O 与H+反应,降低c(H+)浓度,使Fe2++ H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+平衡向正反应方向移动,产生更多的FeC2O4·xH2O;
②根据10FeC2O4xH2O+6KMnO4+4H2SO4═5Fe2(SO4)3+2CO2↑+6MnSO4+3K2SO4+(12+x)H2O可知,n(FeC2O4xH2O)=![]() n(KMnO4)=
n(KMnO4)=![]() ×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=
×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=![]() =180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180,解得x=2;
=180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180,解得x=2;
故答案为:2。


科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:
CH4+ 2H2O![]() CO2+4H2,已知:
CO2+4H2,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
H2O(g)=H2O(l) △H=-44kJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式:____________。
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+ 2H2O(g)![]() CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则①平衡时,CH4的转化率为__________,H2的浓度为_________,反应共放出或吸收热量_______kJ。
②升高平衡体系的温度,混合气体的平均相对分子质量___________,密度_________。(填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”“逆向”或“不”)移动。
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将________(填“正向”“逆向”或“不”)移动。达到新平衡后,容器内H2浓度范围为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是
实验操作及实验现象 | 结 论 | |
A | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应[FeCl3+ 3KSCN |
B | 向做了相同标记的2支试管中均加入2mL 0.1mol/L Na2S2O3溶液,再分别向2支试管中加入4mL浓度为0.1mol/L、0.5mol/L 的H2SO4溶液,测定恰好遮挡全部标记所用时间 | 其他条件一定时,反应物浓度越大,化学反应速率越快 |
C | 室温下,用广泛pH试纸测定0.1 mol/L Na2SO3溶液的pH为10,0.1mol/L NaHSO3溶液的pH为5 | 相同条件下,HSO3-的水解能力强于SO32- |
D | 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀,再加入1mL0.1mol/L KI溶液,生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.用玻璃棒搅拌漏斗中的液体以加快过滤速度
B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
D.分液时,下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验中,不能达到相应实验目的的是
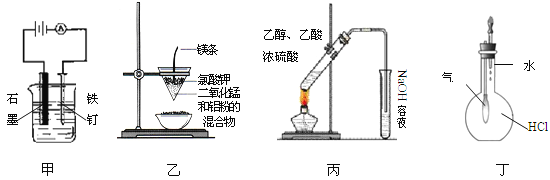
A.装置甲:防止铁钉生锈
B.装置乙:可制得金属锰
C.装置丙:实验室制取乙酸乙酯
D.装置丁:验证HCl气体在水中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷作为溶剂,其中分子结构为正四面体的是____________,工业上分离这些多氯代甲烷的方法是__________________;
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式:__________________________(不考虑立体异构);
(3)聚氯乙烯是生活中常见的塑料。工业生产聚氯乙烯的一种工艺路线如下:
乙烯![]() 1,2-二氯乙烷
1,2-二氯乙烷![]() 氯乙烯
氯乙烯![]() 聚氯乙烯
聚氯乙烯
反应①的化学方程式是______________________,反应类型为____________,反应②的反应类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定H2C2O4溶液,当_________________时,滴定结束。
④记录数据,重复实验。整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)步骤①需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为______(填名称)。
(2)该反应原理的化学方程式为_________________;
(3)请将步骤③补充完整__________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______________mol/L,x=____________;
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会__________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现T°C时,甲醇(CH3OH)在铜基催化剂上的反应机理如下:
反应I: CH3OH(g)=CO(g)+2H2 (g) H1=akJ/mol
反应Ⅱ: CO(g)+H2O(g)=CO2 (g)+H2 (g) H2=-bkJ/mol (b>0)
总反应: CH3OH(g)+H2O(g)=CO2 (g)+3H2(g)H3= ckJ/mol

下列有关说法中正确的是( )
A.反应I是放热反应
B.1mol CH3OH(g)和H2O(g)的总能量大于1mol CO2(g)和3mol H2(g)的总能量
C.c>0
D.优良的催化剂降低了反应的活化能,并减少H3,节约了能源。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图。根据题意回答问题:
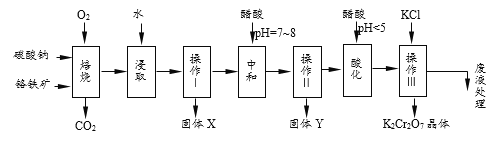
已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
③Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(2)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。酸化步骤用醋酸调节溶液pH<5,其目的是________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、_______、过滤、_______、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com