
【题目】下列实验操作正确的是
A.用玻璃棒搅拌漏斗中的液体以加快过滤速度
B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
D.分液时,下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
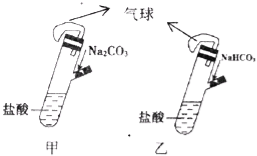
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体混合物X可能含有NaNO2、Na2SiO3、FeCl3、KAlO2中的一种或几种物质,某同学对该固体进行了如下实验:

下列判断正确的是
A.溶液甲中一定含有NaNO2、Na2SiO3,可能含有FeCl3、KAlO2
B.原固体混合物X中一定有KAlO2
C.固体乙、固体丁一定是纯净物
D.将溶液乙和溶液丁混合一定有无色气体生成,可能有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。CO2与H2合成二甲醚(CH3OCH3)是一种CO2转化方法,其过程中主要发生下列反应:
反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
反应II 2CH3OH(g)![]() CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
反应III CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=41.2 kJ.mol-1
CO(g)+H2O(g) △H3=41.2 kJ.mol-1
(1)写出CO2与H2一步合成二甲醚(反应IV)的热化学反应方程式:_______________
(2)有利于提高反应IV平衡转化率的条件是_______。
A.高温高压 B.低温诋压 C.高温低压 D.低温高压
(3)在恒压、CO2和H2起始物质的量之比为1:3的条件下,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图1。CH3OCH3的选择性=![]()
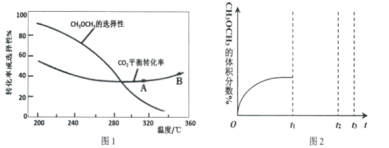
①温度低于300℃,CO2平衡转化率随温度升高而下降的原因是_____________________
②关于合成二甲醚工艺的理解,下列说法正确的是_____________
A.反应IV在A点和B点时的化学平衡常数K(A)小于K(B)
B.当温度、压强一定时,在原料气(CO2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低
D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
③在某温度下,若加入CO2的物质的量为1mol,生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,则CO2转化率为__________________
④一定温度压强下,二甲醚的体积分数随时间变化如图2所示。在t1时刻,再加入物质的量之比为1:3的CO2和H2,t2时刻重新达到平衡。画出t1—t3时刻二甲醚体积分数的变化趋势。__________________
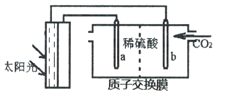
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造海绵的主要成分是聚氨酯,合成方法如下:
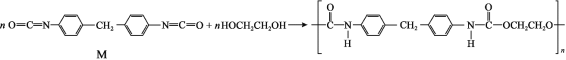
下列说法不正确的是( )
A.M的分子式为C15H10N2O2
B.合成聚氨酯的反应属于缩聚反应
C.聚氨酯在一定条件下可发生水解反应
D.聚氨酯和蛋白质分子中均含有![]() 结构
结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向)

已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称是 ______ ,B的结构简式是___________________。
(2)B→C和G→J两步的反应类型分别为 ___________,____________。
(3)①E+F→H的化学方程式是____________________________________。
②D与银氨溶液反应的化学方程式是__________________________________。
(4)E的同系物K比E相对分子质量大28,则K的同分异构体共 ______ 种,其中核磁共振氢谱显示为4组峰,且峰面积之比为6:2:1:1,写出符合要求的该同分异构体的结构简式为(写出1种即可) ____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1) 室温下,测得 0.1 mol·L1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式_______。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
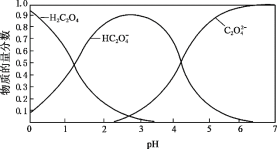
① 向草酸溶液中滴加KOH溶液至pH = 2.5时发生的主要反应的离子方程式是_______。
② 0.1 mol·L1 KHC2O4溶液中,下列粒子浓度关系正确的是_______(填序号)。
a.c(K+) + c(H+) = c(HC2O4–) + c(C2O42–) + c(OH–)
b.c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4)
c.c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+
① 制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_____。
② 测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+则FeC2O4·xH2O中x = _______(FeC2O4的摩尔质量是144 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子H是人造棉的成分之一,其合成路线如下:

已知:Ⅰ.R1COOR2+R3CH2COOR4![]()
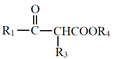 +R2OH
+R2OH
Ⅱ.RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
(R1、R2、R3、R4、R’、R”代表烃基)
(1)按官能团分类,A的类别是_______。
(2)B为不饱和醇,A→B的反应类型是_______。
(3)C的名称是_______。
(4)D的核磁共振氢谱显示其分子有2种不同环境的氢原子,D的结构简式是_______。
(5)E→F的化学方程式是_______。
(6)G分子内含有一个六元环(含“![]() ”结构)。
”结构)。
① 下列试剂能使![]() 转化为
转化为![]() 的是_______(填序号)。
的是_______(填序号)。
a.![]() b.
b.![]() c.
c.![]()
② G→H的反应类型为缩聚反应,该反应还有![]() 生成,其化学方程式是_______。
生成,其化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解200mLH2SO4和CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),原混合溶液中Cu2+的物质的量浓度为( )
A.0.2mol·L-1B.0.3mol·L-1C.0.4mol·L-1D.0.5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com