
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。CO2与H2合成二甲醚(CH3OCH3)是一种CO2转化方法,其过程中主要发生下列反应:
反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
反应II 2CH3OH(g)![]() CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
反应III CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=41.2 kJ.mol-1
CO(g)+H2O(g) △H3=41.2 kJ.mol-1
(1)写出CO2与H2一步合成二甲醚(反应IV)的热化学反应方程式:_______________
(2)有利于提高反应IV平衡转化率的条件是_______。
A.高温高压 B.低温诋压 C.高温低压 D.低温高压
(3)在恒压、CO2和H2起始物质的量之比为1:3的条件下,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图1。CH3OCH3的选择性=![]()
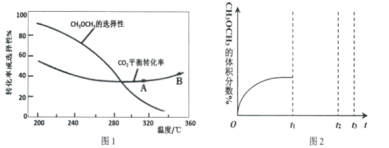
①温度低于300℃,CO2平衡转化率随温度升高而下降的原因是_____________________
②关于合成二甲醚工艺的理解,下列说法正确的是_____________
A.反应IV在A点和B点时的化学平衡常数K(A)小于K(B)
B.当温度、压强一定时,在原料气(CO2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低
D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
③在某温度下,若加入CO2的物质的量为1mol,生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,则CO2转化率为__________________
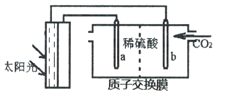
④一定温度压强下,二甲醚的体积分数随时间变化如图2所示。在t1时刻,再加入物质的量之比为1:3的CO2和H2,t2时刻重新达到平衡。画出t1—t3时刻二甲醚体积分数的变化趋势。__________________
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为____________________
【答案】2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol-1 D 反应Ⅲ的ΔH >0,温度升高,二氧化碳的平衡转化率变大,而反应Ⅰ(或者反应Ⅳ)的ΔH <0,温度升高,二氧化碳的平衡转化率下降,且上升幅度小于下降幅度; CD 50%或0.5
CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol-1 D 反应Ⅲ的ΔH >0,温度升高,二氧化碳的平衡转化率变大,而反应Ⅰ(或者反应Ⅳ)的ΔH <0,温度升高,二氧化碳的平衡转化率下降,且上升幅度小于下降幅度; CD 50%或0.5 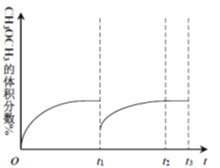 12H++2CO2+12e-=CH3OCH3+3H2O
12H++2CO2+12e-=CH3OCH3+3H2O
【解析】
(1)根据盖斯定律分析,反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1, 反应II 2CH3OH(g)
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1, 反应II 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=- 24.5 kJ.mol-1,有I ×2+II得热化学方程式2CO2(g)+6H2(g)
CH3OCH3(g)+H2O(g) △H2=- 24.5 kJ.mol-1,有I ×2+II得热化学方程式2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-49.0×2- 24.5=-122.5kJ·mol-1;
CH3OCH3(g)+3H2O(g) ΔH=-49.0×2- 24.5=-122.5kJ·mol-1;
(2)反应IV为放热反应,A.高温平衡逆向移动,高压平衡正向移动,故此条件不能确定平衡的移动方向,不能确定是否提高转化率,故错误;B.低温平衡正向移动,低压平衡逆向移动,故不能确定是否提高转化率,故错误;C.高温平衡逆向移动,低压平衡逆向移动,转化率降低,故错误;D.低温高压都能使平衡正向移动,提高转化率,故正确。
(3)①反应Ⅲ的ΔH >0,温度升高,平衡正向移动,二氧化碳的平衡转化率变大,而反应Ⅰ(或者反应Ⅳ)的ΔH <0,温度升高,平衡逆向移动,二氧化碳的平衡转化率下降,且上升幅度小于下降幅度,所以随着温度升高,二氧化碳的平衡转化率下降;
②A.从图分析反应IV随着温度升高,二氧化碳的平衡转化率A点小于B点,但二甲醚的选择性降低,说明反应IV进行程度减小,所以在A点和B点时的化学平衡常数K(A)大于K(B),故错误;
B.当温度、压强一定时,在原料气(C02和H2的比例不变)中添加少量惰性气体,容器的体积增大,相当于减压,平衡逆向移动,不有利于提高平衡转化率,故错误;
C.其他条件不变,在恒容条件下反应体系中的压强逐渐减小,二甲醚平衡选择性比恒压条件下的平衡选择性低,故正确;
D.提高催化剂的活性和选择性,可以控制三个反应是否进行,减少CO等副产物是工艺的关键,故正确;故选CD。
③生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,说明有0.4mol二氧化碳转化生成二甲醚,生成二甲醚的选择性为80%,即有0.5mol二氧化碳参与反应,则二氧化碳的转化率为![]() =50%或0.5。
=50%或0.5。
④反应到平衡后,在t1时刻,再加入物质的量之比为1:3的CO2和H2,加入时二甲醚的体积分数减小,平衡正向移动,二甲醚的体积分数逐渐增加,因为是在恒温恒压条件下,再加入等物质的量比的二氧化碳和氢气,所以属于等效平衡,即平衡时二甲醚的体积分数不变。所以图像如下: 。
。
④该装置为电解装置,二氧化碳变成二甲醚是得到电子的过程,根据图中质子交换膜分析,反应中的离子只能写氢离子,所以电极反应为12H++2CO2+12e-=CH3OCH3+3H2O。


科目:高中化学 来源: 题型:
【题目】碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的碘元素。沿海地区居民常食用海带,因此,甲状腺肿大等碘缺乏病发病率低。已知,碘元素以碘离子的形式存在,常温下I-能被氯水氧化为I2;I2在有机溶剂中的溶解度明显大于在水中的溶解度;I2有颜色,而I-无颜色。实验室里从海藻中提取碘的流程如图所示:
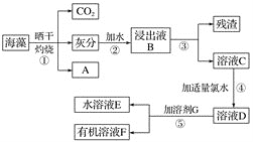
(1)写出A的化学式______________。
(2)步骤③操作所需要的玻璃仪器是______________、______________、__________________。
(3)下列有机溶剂中不可作为溶剂G的有________(填下面的序号)。
A.酒精 B.四氯化碳 C.乙酸 D.汽油 E.苯
(4)步骤⑤的操作名称是__________、分液;溶液E的颜色比溶液F的颜色______(填“深”或“浅”)。
(5)步骤⑤中,若选用(3)中的__________(填溶液名称)为溶剂G,分液时,应先把溶液____(填“E”或“F”)从分液漏斗的下部排出,之后,再把另一溶液从分液漏斗的上口倒出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是( )
A. 实验室制取氨气
实验室制取氨气
B.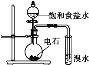 证明乙炔可使溴水褪色
证明乙炔可使溴水褪色
C.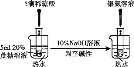 检验蔗糖的水解产物具有还原性
检验蔗糖的水解产物具有还原性
D.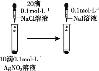 证明溶解度:AgCl>AgI
证明溶解度:AgCl>AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是
实验操作及实验现象 | 结 论 | |
A | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应[FeCl3+ 3KSCN |
B | 向做了相同标记的2支试管中均加入2mL 0.1mol/L Na2S2O3溶液,再分别向2支试管中加入4mL浓度为0.1mol/L、0.5mol/L 的H2SO4溶液,测定恰好遮挡全部标记所用时间 | 其他条件一定时,反应物浓度越大,化学反应速率越快 |
C | 室温下,用广泛pH试纸测定0.1 mol/L Na2SO3溶液的pH为10,0.1mol/L NaHSO3溶液的pH为5 | 相同条件下,HSO3-的水解能力强于SO32- |
D | 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀,再加入1mL0.1mol/L KI溶液,生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol/LNH4HCO3溶液,溶液pH为7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法不正确的是

A.NH4HCO3溶液中存在下列关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
C.向该溶液中加入少量氢氧化钠固体时,c(HCO3-)、c(NH4+)均减小
D.通过分析可知常温下Kb(NH3·H2O)<Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.用玻璃棒搅拌漏斗中的液体以加快过滤速度
B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
D.分液时,下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷作为溶剂,其中分子结构为正四面体的是____________,工业上分离这些多氯代甲烷的方法是__________________;
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式:__________________________(不考虑立体异构);
(3)聚氯乙烯是生活中常见的塑料。工业生产聚氯乙烯的一种工艺路线如下:
乙烯![]() 1,2-二氯乙烷
1,2-二氯乙烷![]() 氯乙烯
氯乙烯![]() 聚氯乙烯
聚氯乙烯
反应①的化学方程式是______________________,反应类型为____________,反应②的反应类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是以实验为基础的自然科学,化学实验操作中必须十分重视安全问题和环境保护问题.下列实验问题处理方法正确的是( )
A.浓硫酸不小心沾到皮肤上,立刻用NaOH溶液洗涤
B.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
C.实验室制取气体时应先检查装置的气密性
D.做氢气还原氧化铜的实验时先加热再通氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com