
【题目】下列实验不能达到实验目的的是( )
A. 实验室制取氨气
实验室制取氨气
B.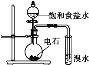 证明乙炔可使溴水褪色
证明乙炔可使溴水褪色
C.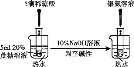 检验蔗糖的水解产物具有还原性
检验蔗糖的水解产物具有还原性
D.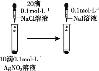 证明溶解度:AgCl>AgI
证明溶解度:AgCl>AgI
【答案】B
【解析】
A. 该图为实验室制用氯化铵和氢氧化钙取氨气的实验装置图,故A正确;
B. 得到的乙炔中含有硫化氢等气体,硫化氢等气体也能使溴水褪色,应该先将得到的气体通入硫酸铜溶液除去杂质,然后将得到的气体通入溴水检验乙炔,故B错误;
C. 检验蔗糖水解产物葡萄糖具有还原性:蔗糖在酸性条件下水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热,在加入银氨溶液之前必须加入NaOH溶液中和未反应的稀硫酸,否则稀硫酸和银氨溶液反应而得不到Ag,故C正确;
D. 向AgNO3溶液中滴加少量NaCl溶液,然后再向其中滴加KI溶液,先生成白色沉淀,后生成黄色沉淀,说明AgI更难溶,溶度积越小其溶解度越小,则溶解度:AgCl>AgI,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
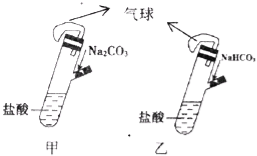
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
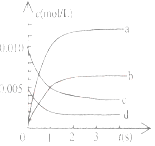
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素能形成多种单质如金刚石、石墨等,24g 金刚石中含有_______个碳碳单键。碳元素也能形成多种化合物,在形成化合物时,其所成化学键以共价键为主,原因是 _______。
(1)工业制镁时,电解 MgCl2 而不电解 MgO 的原因是 _______。
(2)BeCl2 熔点较低,易升华,能溶于有机溶剂。由此可推测 BeCl2 晶体为 _______晶体(填晶体类型),其分子为_______分子(填“极性”或“非极性”),分子构型为_______,BeCl2 熔点_______(选填“低于”或“高于”)BeBr2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
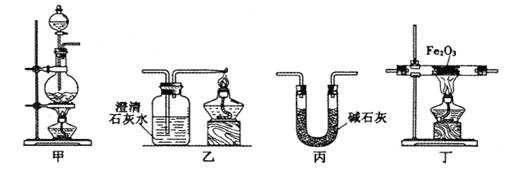
(1)装置甲中发生的反应为:HCOOH(甲酸)![]() CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→(_____)→(_____)→(_____)
(3)丙装置中碱石灰的作用是__________________________。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为__________。
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
加热方式 | 通CO加热时间/min | 澄清石灰水变浑浊时间/min | 产物颜色 | 产物能否全部被磁铁吸引 |
酒精灯 | 30 | 5 | 黑色 | 能 |
酒精喷灯 | 30 | 1 | 黑色 | 能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:____、____。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.________;iii.___________。
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
样品序号 | 加热方式 | 元素组成和质量分数 |
产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
产物样品II | 酒精喷灯 | w(Fe)=100% |
样品I的成分及质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体混合物X可能含有NaNO2、Na2SiO3、FeCl3、KAlO2中的一种或几种物质,某同学对该固体进行了如下实验:

下列判断正确的是
A.溶液甲中一定含有NaNO2、Na2SiO3,可能含有FeCl3、KAlO2
B.原固体混合物X中一定有KAlO2
C.固体乙、固体丁一定是纯净物
D.将溶液乙和溶液丁混合一定有无色气体生成,可能有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。CO2与H2合成二甲醚(CH3OCH3)是一种CO2转化方法,其过程中主要发生下列反应:
反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
反应II 2CH3OH(g)![]() CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
反应III CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=41.2 kJ.mol-1
CO(g)+H2O(g) △H3=41.2 kJ.mol-1
(1)写出CO2与H2一步合成二甲醚(反应IV)的热化学反应方程式:_______________
(2)有利于提高反应IV平衡转化率的条件是_______。
A.高温高压 B.低温诋压 C.高温低压 D.低温高压
(3)在恒压、CO2和H2起始物质的量之比为1:3的条件下,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图1。CH3OCH3的选择性=![]()
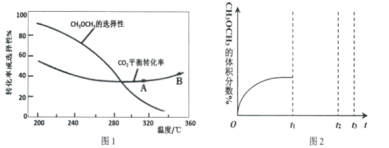
①温度低于300℃,CO2平衡转化率随温度升高而下降的原因是_____________________
②关于合成二甲醚工艺的理解,下列说法正确的是_____________
A.反应IV在A点和B点时的化学平衡常数K(A)小于K(B)
B.当温度、压强一定时,在原料气(CO2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低
D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
③在某温度下,若加入CO2的物质的量为1mol,生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,则CO2转化率为__________________
④一定温度压强下,二甲醚的体积分数随时间变化如图2所示。在t1时刻,再加入物质的量之比为1:3的CO2和H2,t2时刻重新达到平衡。画出t1—t3时刻二甲醚体积分数的变化趋势。__________________
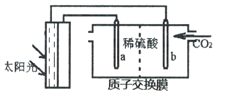
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子H是人造棉的成分之一,其合成路线如下:

已知:Ⅰ.R1COOR2+R3CH2COOR4![]()
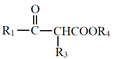 +R2OH
+R2OH
Ⅱ.RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
(R1、R2、R3、R4、R’、R”代表烃基)
(1)按官能团分类,A的类别是_______。
(2)B为不饱和醇,A→B的反应类型是_______。
(3)C的名称是_______。
(4)D的核磁共振氢谱显示其分子有2种不同环境的氢原子,D的结构简式是_______。
(5)E→F的化学方程式是_______。
(6)G分子内含有一个六元环(含“![]() ”结构)。
”结构)。
① 下列试剂能使![]() 转化为
转化为![]() 的是_______(填序号)。
的是_______(填序号)。
a.![]() b.
b.![]() c.
c.![]()
② G→H的反应类型为缩聚反应,该反应还有![]() 生成,其化学方程式是_______。
生成,其化学方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com