
【题目】用如图所示的装置进行中和热的测定实验,分别取50 mL 0.55 mol/L的NaOH溶液、50 mL 0.25 mol/L的硫酸进行实验,回答下列问题:
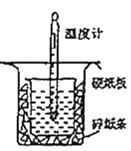
(1)从图中实验装置看,其中尚缺少的用品是_______,除此之外,装置中的一个明显错误是_______。
(2)近似认为0.55 mol/L的NaOH溶液和0.25 mol/L的硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以下数据计算中和热△H=_________。(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用50 mL0.25 mol/L的H2SO4和50 mL0.55 mol/L的NH2·H2O溶液进行反应,与上述实验相比,所放出的热量_______(填“不变”“偏高"或“偏低”)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是________(填字母)。
a. 实验装置保温、隔热效果差
b. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 将以上四实验测量温度均纳入计算平均值
【答案】环形玻璃搅拌棒 未将大烧杯杯口与小烧杯杯口保持相平 -56.8 kJ/mol 偏低 abc
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平,两烧杯之间塞满碎泡沫塑料;大烧杯上如不盖硬纸板,会使一部分热量散失;
(2)先判断温度差的有效性,然后求出温度差平均值;根据Q=cm△T计算反应放出的热量,最后根据△H= -![]() kJ/mol计算出反应热;
kJ/mol计算出反应热;
(3)根据弱电解质电离吸收热量分析反应放出的热量的多少;
(4)a. 装置保温、隔热效果差,测得的热量偏小;
b. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小;
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失;
d. 若将以上四实验测量温度均纳入计算平均值,反应放出热量使溶液升高的平均温度△T=3.825℃,则可根据Q=cm△T计算生成0.025 mol水放出的热量然后利用△H= -![]() kJ/mol计算出反应热、最后进行判断。
kJ/mol计算出反应热、最后进行判断。
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平,两烧杯之间塞满碎泡沫塑料;大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:环形玻璃棒;未将小烧杯和大烧杯杯口保持相平;
(2)4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,可见第2组数据无效,温度差平均值△T =![]() ℃=3.4℃;50 mL0.25 mol/L硫酸中的H+与50 mL0.55 mol/L碱NaOH溶液z OH-的物质的量少,进行中和反应生成水的物质的量根据硫酸计算,n(H2O)= 0.25 mol/L×2×0.05 L=0.025 mol,反应后溶液的质量m(溶液)=100 mL×1 g/mL=100 g,温度变化的值为△T=3.4℃,则生成0.025 mol水放出的热量为Q=cm△T=4.18 J/(g℃)×100 g×3.4℃=1421.2 J=1.4212 kJ,所以实验测得的中和热△H= -
℃=3.4℃;50 mL0.25 mol/L硫酸中的H+与50 mL0.55 mol/L碱NaOH溶液z OH-的物质的量少,进行中和反应生成水的物质的量根据硫酸计算,n(H2O)= 0.25 mol/L×2×0.05 L=0.025 mol,反应后溶液的质量m(溶液)=100 mL×1 g/mL=100 g,温度变化的值为△T=3.4℃,则生成0.025 mol水放出的热量为Q=cm△T=4.18 J/(g℃)×100 g×3.4℃=1421.2 J=1.4212 kJ,所以实验测得的中和热△H= -![]() =-56.8 kJ/mol;
=-56.8 kJ/mol;
(3)NH2·H2O是弱电解质,电离过程吸收热量,使反应放出的热量偏低;
(4)a. 装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,a符合题意;
b. 温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,导致测定的中和热的数值偏小,b符合题意;
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,c符合题意;
d. 若将以上四实验测量温度均纳入计算平均值,为△T=3.825℃,则生成0.025 mol水放出的热量为Q= cm△T=4.18J/(g℃)×100 g×3.825 ℃=1598.85 J=1.59885 kJ,所以实验测得的中和热△H= -![]() =-63.9 kJ/mol,反应热偏大,不符合偏小实际,d不符合题意;
=-63.9 kJ/mol,反应热偏大,不符合偏小实际,d不符合题意;
故合理选项是abc。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】芬太尼(结构式如图)是一种强效的类阿片止痛剂,起效迅速而作用时间极短。当它与药物联合使用时,通常用作疼痛药物或麻醉剂。下列说法正确的是

A. 它的分子式是C22H27N2O B. 它和苯是同系物
C. 它属于烃的衍生物 D. 药物可以过量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电池在运行时可同时实现净化有机物污水、净化含Cr2O72-废水(pH约为6)和淡化食盐水,其装置示意图如下图所示。图中,D和E为阳离子交换膜或阴离子交换膜,Z为待淡化食盐水。已知Cr3+完全沉淀所需的pH为5.6。下列说法不正确的是
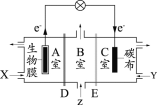
A.E为阴离子交换膜
B.X为有机物污水,Y为含Cr2O72-废水
C.理论上处理1mol的Cr2O72-的同时可脱除6mol的NaCl
D.C室的电极反应式为Cr2O72- + 6e- + 8H+=2Cr(OH)3↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60可用作储存氢气的材料,结构如右图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是
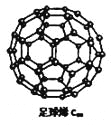
A.C60、Si60、N60都属于原子晶体
B.C60、Si60、N60分子内共用电子对数目相同
C.由于![]() 键能小于
键能小于![]() ,故N60的稳定性弱于N2
,故N60的稳定性弱于N2
D.由于![]() 键长小于
键长小于![]() 键,所以C60熔、沸点低于Si60
键,所以C60熔、沸点低于Si60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是一种重要的有机合成原料,用氯苯合成染料中间体F的两条路线如下图所示。
路线1: 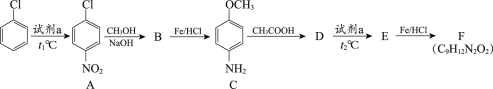
路线2: 
(1)试剂a为________。
(2)A→B的反应类型为取代反应,该反应的化学方程式为________。
(3)B→C的反应类型为________。
(4)C与CH3COOH的相对分子质量之和比D的相对分子质量大18,D→E的取代反应发生在甲氧基(—OCH3)的邻位,F的结构简式为________。
(5)G的结构简式为________。
(6)有机物I与对苯二甲酸(![]() )发生聚合反应的化学方程式为_____。
)发生聚合反应的化学方程式为_____。
(7)I与CH3COOH反应生成的有机产物除F外,还可能有________(写出结构简式)。
(8)满足下列条件的C的同分异构体有________种。①与FeCl3溶液发生显色反应②分子中含有—NH2③苯环上有3种氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ | ||
SO2 | O2 | SO3 | ||
甲 | 2 | 1 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N﹣N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )
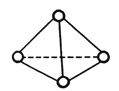
A.N4与N2互为同素异形体
B.1 mol N4气体转化为N2时要放出724 kJ能量
C.N4变成N2是化学变化
D.N4不可能是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1 mol C3H6Cl2中化学键总数为![]()
B.42 g乙烯中含碳原子数为3![]()
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22.4)![]()
D.0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com