
【题目】NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1 mol C3H6Cl2中化学键总数为![]()
B.42 g乙烯中含碳原子数为3![]()
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22.4)![]()
D.0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3![]()
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子—M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) △H2=-0.92 kJ/mol
(2)O2(g)=O2(l) △H2=-6.84 kJ/mol
(3)如图:下列说法正确的是( )
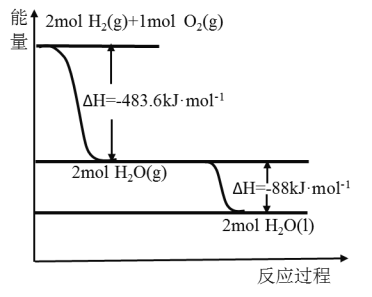
A.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) △H=-474.92 kJ/mol
B.氢气的燃烧热为△H=-241.8 kJ/mol
C.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行中和热的测定实验,分别取50 mL 0.55 mol/L的NaOH溶液、50 mL 0.25 mol/L的硫酸进行实验,回答下列问题:
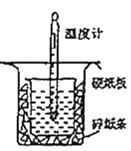
(1)从图中实验装置看,其中尚缺少的用品是_______,除此之外,装置中的一个明显错误是_______。
(2)近似认为0.55 mol/L的NaOH溶液和0.25 mol/L的硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以下数据计算中和热△H=_________。(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用50 mL0.25 mol/L的H2SO4和50 mL0.55 mol/L的NH2·H2O溶液进行反应,与上述实验相比,所放出的热量_______(填“不变”“偏高"或“偏低”)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是________(填字母)。
a. 实验装置保温、隔热效果差
b. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 将以上四实验测量温度均纳入计算平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请把下列现象中浓硫酸表现出来的性质写填在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现___(填“脱水性”或“氧化性”);
(2)盛有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出___(填“吸水性”或“脱水性”);
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、SO2和Cl2是中学化学常见的气体,研究其性质和制备具有重要意义。回答下列问题:
(1)实验室中干燥氨气常用的干燥剂是___(填“碱石灰”或“五氧化二磷”)。
(2)某同学用干燥的圆底烧瓶收集满一瓶干燥氨气,进行喷泉实验并取得成功。说明氨气___(填“极易”或“不易”)溶于水;圆底烧瓶中溶液变红色,说明氨水呈___(填“酸性”或“碱性”)。
(3)某兴趣小组为验证SO2和Cl2的漂白性;设计了如下方案(尾气处理装置未画出)。

①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液呈___(填“红”或“无”)色;
②如图乙所示,将干燥的Cl2和SO2按体积比1:l混合通入石蕊溶液中,发现石蕊溶液变红,不褪色,用化学方程式解释之:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)五种物质中:①CH3CHO②CH3CH2OH③![]() ④HCOOC2H5⑤CH3COOH
④HCOOC2H5⑤CH3COOH
(1)能与NaOH溶液反应的有________(填写序号,下同);
(2)能发生银境反应的有________;
(3)既能发生酯化反应,又能发生消去反应的有___________;
(4)能和NaHCO3反应的有______________。
(II)下列物质是几种常见香精的主要成分
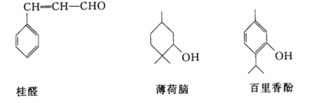
(1)薄荷脑的分子式为___________。
(2)鉴别薄荷脑和百里香酚,可选用的试剂是___________。
(3)下列对于桂醛的说法不正确的是___________。
A.可发生加聚反应 B.可发生取代反应
C.可发生氧化反应 D.最多可与2molH2发生加成反应
(4)写出百里香酚与足量浓溴水反应的化学方程式:_______________________。
(5)写出往百里香酚钠溶液中通入CO2气体的化学反应方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是日常生活中最常见的金属,其转化关系如图(部分反应物或生成物已略去)。
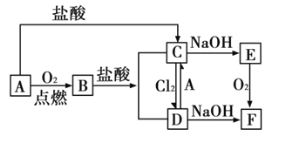
(1)写出![]() 的化学式_____________;溶液
的化学式_____________;溶液![]() 的颜色是______________。
的颜色是______________。
(2)写出下列转化的离子方程式:
①![]() :_________________。
:_________________。
②![]() :__________________。
:__________________。
(3)![]() 转化为
转化为![]() 过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:________________。
过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com