
【题目】NH3、SO2和Cl2是中学化学常见的气体,研究其性质和制备具有重要意义。回答下列问题:
(1)实验室中干燥氨气常用的干燥剂是___(填“碱石灰”或“五氧化二磷”)。
(2)某同学用干燥的圆底烧瓶收集满一瓶干燥氨气,进行喷泉实验并取得成功。说明氨气___(填“极易”或“不易”)溶于水;圆底烧瓶中溶液变红色,说明氨水呈___(填“酸性”或“碱性”)。
(3)某兴趣小组为验证SO2和Cl2的漂白性;设计了如下方案(尾气处理装置未画出)。

①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液呈___(填“红”或“无”)色;
②如图乙所示,将干燥的Cl2和SO2按体积比1:l混合通入石蕊溶液中,发现石蕊溶液变红,不褪色,用化学方程式解释之:___。
【答案】碱石灰 极易 碱性 红 SO2+Cl2+2H2O=H2SO4+2HCl
【解析】
(1)五氧化二磷吸水后生成磷酸,能与氨气反应,实验室中于燥氨气常用的干燥剂是碱石灰(填“碱石灰”或“五氧化二磷”)。故答案为:碱石灰;
(2)用干燥的圆底烧瓶收集满一瓶干燥氨气,进行喷泉实验并取得成功,说明氨气极易溶于水;氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,圆底烧瓶中溶液变红色,说明氨水呈碱性。故答案为:极易;碱性;
NH4++OH-,圆底烧瓶中溶液变红色,说明氨水呈碱性。故答案为:极易;碱性;
(3)①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,说明SO2具有漂白性,停止通气体,加热试管,发现溶液呈红色,说明二氧化硫的漂白具有可逆性;故答案为:红;
②如图乙所示,将干燥的Cl2和SO2按体积比1:l混合通入石蕊溶液中,发现石蕊溶液变红,不褪色,因为SO2和Cl2在水中反应生成H2SO4和HCl,Cl2和SO2按体积比1:l恰好完全反应,溶液呈酸性,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl。故答案为:SO2+Cl2+2H2O=H2SO4+2HCl。


科目:高中化学 来源: 题型:
【题目】已知反应:C8H14O4+2H2O![]() X+2CH3OH(已配平)。符合该反应的有机物X有(不考虑立体异构)( )
X+2CH3OH(已配平)。符合该反应的有机物X有(不考虑立体异构)( )
A.8种B.9种
C.10种D.12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ | ||
SO2 | O2 | SO3 | ||
甲 | 2 | 1 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列大小关系正确的是
A.熔点:己烷>2-甲基丁烷>戊烷>丁烷
B.含氢量:甲烷>乙烷>乙烯>乙炔>苯
C.密度:苯>H2O>CCl4
D.相同物质的量物质完全燃烧耗氧量:己烷>环己烷>苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1 mol C3H6Cl2中化学键总数为![]()
B.42 g乙烯中含碳原子数为3![]()
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22.4)![]()
D.0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是______(填字母)。
A.海水提溴:海水浓缩![]()
![]() 溴蒸气
溴蒸气![]()
![]()
![]() 液溴
液溴
B.海水提镁:海滩贝壳![]()
![]() 石灰乳
石灰乳![]()
![]()
![]() MgO
MgO![]() 镁
镁
C.海带提碘:海带灼烧![]()
![]() 滤液
滤液![]() 含碘有机溶液
含碘有机溶液![]() 碘晶体
碘晶体
D.海盐提纯:海盐![]()
![]()
![]() 精盐
精盐
![]()
![]() 滤液
滤液![]()
![]() 食盐晶体
食盐晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:
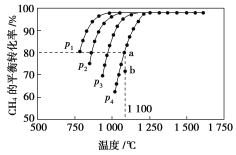
则:(1)该反应的ΔH________0(填“<”“=”或“>”)。
(2)压强p1、p2、p3、p4由大到小的顺序为______________。压强为p4时,在b点:v(正)________v(逆)(填“<”“=”或“>”)。
(3)对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=________;如果p4=0.36 MPa,求a点的平衡常数Kp=________ (保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。
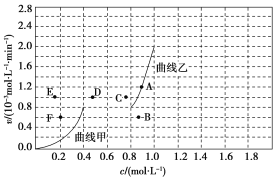
则:①与曲线v正~c(CH4)相对应的是上图中曲线______(填“甲”或“乙”)。
②当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)表中元素原子半径最大的原子共占据的轨道数是_________个,Y最外层电子排布式为________,Z原子核外有_____种能量不同的电子。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
从原子结构的角度去解释Y元素的非金属性比S元素的非金属性强的原因:_______
(3)CO2的沸点_________CS2(填“>”或“<”或“=”),原因是_________________
(4)如果向BaCl2溶液中通入足量CO2气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用电离平衡移动原理解释上述现象。________
(5)过量的CO2通入NaOH溶液中,得到NaHCO3,在0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=________其中有关碳微粒的关系为:___________ = 0.1mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com