
【题目】下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是______(填字母)。
A.海水提溴:海水浓缩![]()
![]() 溴蒸气
溴蒸气![]()
![]()
![]() 液溴
液溴
B.海水提镁:海滩贝壳![]()
![]() 石灰乳
石灰乳![]()
![]()
![]() MgO
MgO![]() 镁
镁
C.海带提碘:海带灼烧![]()
![]() 滤液
滤液![]() 含碘有机溶液
含碘有机溶液![]() 碘晶体
碘晶体
D.海盐提纯:海盐![]()
![]()
![]() 精盐
精盐
![]()
![]() 滤液
滤液![]()
![]() 食盐晶体
食盐晶体
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请把下列现象中浓硫酸表现出来的性质写填在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现___(填“脱水性”或“氧化性”);
(2)盛有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出___(填“吸水性”或“脱水性”);
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、SO2和Cl2是中学化学常见的气体,研究其性质和制备具有重要意义。回答下列问题:
(1)实验室中干燥氨气常用的干燥剂是___(填“碱石灰”或“五氧化二磷”)。
(2)某同学用干燥的圆底烧瓶收集满一瓶干燥氨气,进行喷泉实验并取得成功。说明氨气___(填“极易”或“不易”)溶于水;圆底烧瓶中溶液变红色,说明氨水呈___(填“酸性”或“碱性”)。
(3)某兴趣小组为验证SO2和Cl2的漂白性;设计了如下方案(尾气处理装置未画出)。

①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液呈___(填“红”或“无”)色;
②如图乙所示,将干燥的Cl2和SO2按体积比1:l混合通入石蕊溶液中,发现石蕊溶液变红,不褪色,用化学方程式解释之:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)五种物质中:①CH3CHO②CH3CH2OH③![]() ④HCOOC2H5⑤CH3COOH
④HCOOC2H5⑤CH3COOH
(1)能与NaOH溶液反应的有________(填写序号,下同);
(2)能发生银境反应的有________;
(3)既能发生酯化反应,又能发生消去反应的有___________;
(4)能和NaHCO3反应的有______________。
(II)下列物质是几种常见香精的主要成分
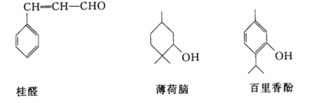
(1)薄荷脑的分子式为___________。
(2)鉴别薄荷脑和百里香酚,可选用的试剂是___________。
(3)下列对于桂醛的说法不正确的是___________。
A.可发生加聚反应 B.可发生取代反应
C.可发生氧化反应 D.最多可与2molH2发生加成反应
(4)写出百里香酚与足量浓溴水反应的化学方程式:_______________________。
(5)写出往百里香酚钠溶液中通入CO2气体的化学反应方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
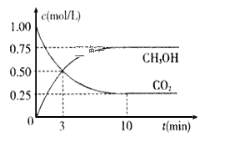
(1)写出该反应的平衡常数表达式_____________________。
(2)达到平衡状态的时刻是__________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_________mol/(L·min)。
(CO2)=_________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为____________。
(5)该温度下,反应的化学平衡常数数值是____________。
(6)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)
CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料。由A制备高分子降解塑料(PVB)和IR的合成路线(部分反应条件略去)如图所示:
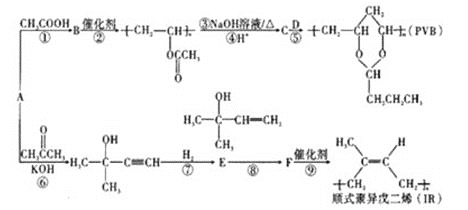
已知:①RCHO+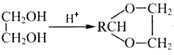 +H2O;
+H2O;
②RBr![]() RCOOH。
RCOOH。
试回答下列问题:
(1)过程①的反应类型为___,B中含氧官能团的名称是___。
(2)反应⑧的化学方程式为___。反应③的化学方程式为___。
(3)关于过程②,下列说法正确的是___(填序号)。
a.反应②属于缩聚反应
b.生成的高分子化合物还能与溴水反应而使其褪色
c.该高分子链节具有和其单体完全一样的结构
d.生成的高分子材料具有热塑性,且为混合物
e.通过质谱仪测得该高分子的平均相对分子质量为30444,可推知其n约为354
(4)F分子中最多有___个原子共平面,D的结构简式是___。
(5)G与E互为同分异构体,则G的所有同分异构体中含有碳碳双键的结构(包含E在内且不考虑顺反异构)共有___种。(已知碳碳双键与羟基直接相连不稳定,不考虑)
(6)利用题目信息,以乙烯为起始原料,选用必要的无机试剂合成丁二酸乙二酯,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。四种盐在不同温度下的溶解度表 (g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | — | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为________________;
②加料完毕,保温30分钟,目的_________;
③过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使_________________(填化学式)循环使用,回收得到NH4Cl晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com