
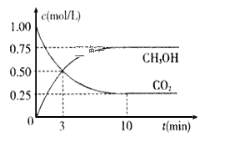
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
(1)写出该反应的平衡常数表达式_____________________。
(2)达到平衡状态的时刻是__________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_________mol/(L·min)。
(CO2)=_________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为____________。
(5)该温度下,反应的化学平衡常数数值是____________。
(6)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)
CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
【答案】c(CH3OH)×c(H2O)/[ c(CO2)×c3(H2)] 10 0.075 16:13 0.67 CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ΔH=-49kJ/mol 73.5
CH3OH(g) +H2O(g) ΔH=-49kJ/mol 73.5
【解析】
根据图像可知,反应在10min时达到平衡,c(CO2)初始时为1mol/L,平衡时为0.25mol/L;c(CH3OH)平衡时为0.75mol/L;初始加入2mol CO2,则容器的体积为2L;则c(H2)初始时为3mol/L,平衡时为1.5mol/L。
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始:1 3 0 0
反应:0.75 1.5 0.75 0.75
平衡:0.25 1.5 0.75 0.75
(1)K=![]()
(2)反应在10min时各物质的浓度不再改变,达到平衡;
(3)在前10min内,![]() (CO2)=c/t=
(CO2)=c/t=![]() =0.075mol/(Lmin);
=0.075mol/(Lmin);
(4)恒温恒容条件下,压强之比等于物质的量之比,压强之比=8:6.5=16:13;
(5)K=![]() =
= ![]() =0.67;
=0.67;
(6)根据盖斯定律可知,①-②可得CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ΔH=-49kJ/mol;10min时,CO2反应1.5mol,释放49×1.5=73.5kJ。
CH3OH(g) +H2O(g) ΔH=-49kJ/mol;10min时,CO2反应1.5mol,释放49×1.5=73.5kJ。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是
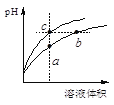
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C.a、b、c三点溶液水的电离程度a>b>c
D.与等体积b、c处溶液反应,消耗等量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列大小关系正确的是
A.熔点:己烷>2-甲基丁烷>戊烷>丁烷
B.含氢量:甲烷>乙烷>乙烯>乙炔>苯
C.密度:苯>H2O>CCl4
D.相同物质的量物质完全燃烧耗氧量:己烷>环己烷>苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是______(填字母)。
A.海水提溴:海水浓缩![]()
![]() 溴蒸气
溴蒸气![]()
![]()
![]() 液溴
液溴
B.海水提镁:海滩贝壳![]()
![]() 石灰乳
石灰乳![]()
![]()
![]() MgO
MgO![]() 镁
镁
C.海带提碘:海带灼烧![]()
![]() 滤液
滤液![]() 含碘有机溶液
含碘有机溶液![]() 碘晶体
碘晶体
D.海盐提纯:海盐![]()
![]()
![]() 精盐
精盐
![]()
![]() 滤液
滤液![]()
![]() 食盐晶体
食盐晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:
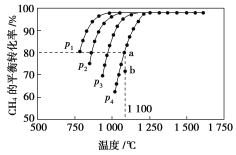
则:(1)该反应的ΔH________0(填“<”“=”或“>”)。
(2)压强p1、p2、p3、p4由大到小的顺序为______________。压强为p4时,在b点:v(正)________v(逆)(填“<”“=”或“>”)。
(3)对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=________;如果p4=0.36 MPa,求a点的平衡常数Kp=________ (保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。
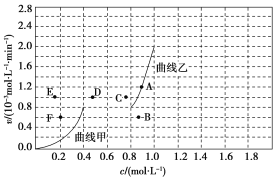
则:①与曲线v正~c(CH4)相对应的是上图中曲线______(填“甲”或“乙”)。
②当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①铜片 ②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧氨水。
⑧氨水。
(1)把上述各物质按物质分类方法填写在下表的空白处(填物质编号)
分类标准 | 碱性氧化物 | 非电解质 | 弱酸 |
属于该类的物质 | ___________ | ___________ | ______________ |
(2)把上述各物质按物质分类方法填写在下表的空白处(填物质编号)。
(3)在标准状况下,相同体积的②和④,其原子个数比为_________。
(4)写出氢氧化钡的电离方程式:______________。
(5)上述物质中有两种物质之间可发生离子反应:![]() ,该离子反应对应的化学方程式为:______________。
,该离子反应对应的化学方程式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C是中学化学中最常见的三种有机物,D是高分子化合物,常用来制造食品和药品包装袋,已知这四种物质之间存在如图所示关系:
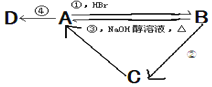
(1)写出反应类型:①___,③____,④____。
(2)反应②的条件是____。
(3)写出化学方程式:B→C:___,A→D:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com