
【题目】图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,③ 是_______。(填微粒符号)
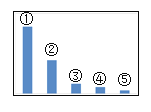
【答案】OH-
【解析】
依据亚硫酸钠为强电解质,完全电离,亚硫酸根离子为多元弱酸根离子,部分发生水解生成亚硫酸氢根离子和氢氧根离子,亚硫酸氢根离子继续水解生成硫离子和氢氧根离子结合水的电离,排序。
Na2SO3是可溶性盐,在水中发生电离:Na2SO3=2Na++SO32-,SO32-在溶液中会发生水解作用:SO32-+H2O![]() HSO3-+OH-,水解产生的HSO3-会进一步发生水解作用:HSO3-+H2O
HSO3-+OH-,水解产生的HSO3-会进一步发生水解作用:HSO3-+H2O![]() H2SO3+OH-,亚硫酸钠虽然能水解,但程度不大,所以溶液中主要离子为钠离子和亚硫酸根离子,所以氢氧根离子浓度略大于HSO3-,由于溶液中c(OH-)>c(H+),溶液显呈碱性,所以H+是最小的,所以离子浓度大小关系为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),③是OH-。
H2SO3+OH-,亚硫酸钠虽然能水解,但程度不大,所以溶液中主要离子为钠离子和亚硫酸根离子,所以氢氧根离子浓度略大于HSO3-,由于溶液中c(OH-)>c(H+),溶液显呈碱性,所以H+是最小的,所以离子浓度大小关系为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),③是OH-。


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图1)。

反应相同时间NOx的去除率随反应温度的变化曲线如题20图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的容器中充入2molA和1molB发生反应:2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
A. 2 B. 3 C. 2或3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)△H=- QkJ/mol(Q>0),在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
CH3CH2OH(g)+3H2O(g)△H=- QkJ/mol(Q>0),在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
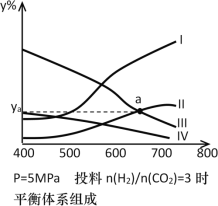
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号);在一定温度下反应达到平衡的标志是______(选填编号)
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(2)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
a.降低温度 b.充入更多的H2 c.移去乙醇 d.增大容器体积
(3)图中曲线II和III的交点a对应物质的体积分数ya=_______%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
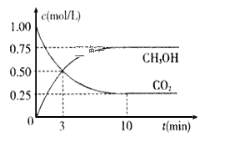
(1)写出该反应的平衡常数表达式_____________________。
(2)达到平衡状态的时刻是__________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_________mol/(L·min)。
(CO2)=_________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为____________。
(5)该温度下,反应的化学平衡常数数值是____________。
(6)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)
CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种新型香料的主要成分之一,其合成路线如下(部分产物和部分反应条件略去):

已知:①RCH=CH2+CH2==CHR′![]() CH2=CH2+RCH=CHR′;
CH2=CH2+RCH=CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2C=CH2的同分异构体中存在顺反异构的有机物的名称为________。
(2)A的核磁共振氢谱除苯环上的H外,还显示________组峰,峰面积比为________。
(3)D分子中含有的含氧官能团名称是________,E的结构简式为__________________。
(4) 发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
(5)G的同分异构体中,同时满足下列条件的有________种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“-COO-”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
肉桂酸苄酯又名苯丙烯酸苄酯,常作为定香剂,也可用于香皂及食品香精的调香原料。以下是一种合成肉桂酸苄酯的路线。
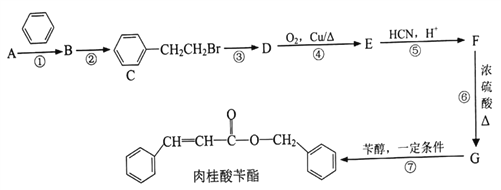
已知:I.相同条件下,烃A对氢气的相对密度为13
Ⅱ.反应①、反应②的原子利用率均为100%
III.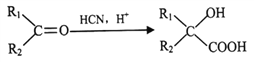
![]()
回答下列问题:
(1)A的名称为____________________。
(2)反应③的条件为____________________。
(3)上述合成路线涉及的反应中,属于取代反应的有___________________〔填编号)。
(4)写出反应D→E的化学方程式__________________________________。
(5)写出G在一定条件下生成的高分子化合物的结构简式__________________。
(6)F同时满足下列条件的同分异构体共有__________种(不考虑立体异构)。
①苯环上有2个取代基
②能发生银镜反应和水解反应
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示6组峰,且峰面积比为3:2:2:1:1:1的是___________(填结构简式)
(7)参照上述合成路线,以CH3CHO为原料,设计制备![]() 的合成线路(无机试剂及溶剂任选) __________________。
的合成线路(无机试剂及溶剂任选) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com