
【题目】已知反应:C8H14O4+2H2O![]() X+2CH3OH(已配平)。符合该反应的有机物X有(不考虑立体异构)( )
X+2CH3OH(已配平)。符合该反应的有机物X有(不考虑立体异构)( )
A.8种B.9种
C.10种D.12种
【答案】B
【解析】
已知反应:C8H14O4+2H2O ![]() X+2CH3OH,说明C8H14O4含有两个酯基,则对应的酸X含有6个C原子,分子式为C6H10O4,含有2个-COOH,可看作2个-COOH取代丁烷上的2个H原子,以此分析解答。
X+2CH3OH,说明C8H14O4含有两个酯基,则对应的酸X含有6个C原子,分子式为C6H10O4,含有2个-COOH,可看作2个-COOH取代丁烷上的2个H原子,以此分析解答。
已知反应:C8H14O4+2H2O ![]() X+2CH3OH,说明C8H14O4含有两个酯基,则对应的酸含有6个C原子,分子式为C6H10O4,含有2个-COOH,可看作2个-COOH取代丁烷上的2个H原子,如图所示:
X+2CH3OH,说明C8H14O4含有两个酯基,则对应的酸含有6个C原子,分子式为C6H10O4,含有2个-COOH,可看作2个-COOH取代丁烷上的2个H原子,如图所示: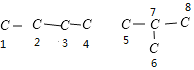 ,则2个-COOH可分别在1、1;2、2;1、2;1、3;1、4;2、3;5、5;5、6;5、7,共9种位置,则同分异构体有9种,故选B。
,则2个-COOH可分别在1、1;2、2;1、2;1、3;1、4;2、3;5、5;5、6;5、7,共9种位置,则同分异构体有9种,故选B。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】化学是以实验为基础的自然科学,化学实验操作中必须十分重视安全问题和环境保护问题.下列实验问题处理方法正确的是( )
A.浓硫酸不小心沾到皮肤上,立刻用NaOH溶液洗涤
B.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
C.实验室制取气体时应先检查装置的气密性
D.做氢气还原氧化铜的实验时先加热再通氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应:2A(s)+2B(g)![]() C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
A.混和气体的平均相对分子质量不再改变
B.混和气体的密度不随时间而变化
C.容器内的压强不随时间而变化
D.A的质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数)( )
A.124gP4含有P—P键的个数为6NA
B.24g石墨中含有六元环个数为3NA
C.46g乙醇中含有极性键的个数为6NA
D.18g冰中含氢键的个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子—M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) △H2=-0.92 kJ/mol
(2)O2(g)=O2(l) △H2=-6.84 kJ/mol
(3)如图:下列说法正确的是( )
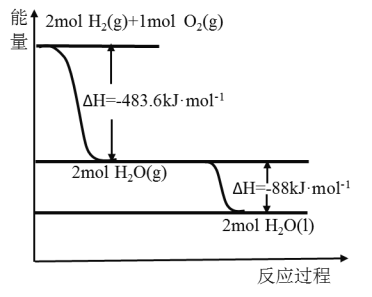
A.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) △H=-474.92 kJ/mol
B.氢气的燃烧热为△H=-241.8 kJ/mol
C.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ/mol、283.0 kJ/mol和890.0 kJ/mol。一定条件下,CO与H2合成燃烧的热化学方程式为:CO(g)+3H2(g)=CH4(g)+H2O(l) △H,则△H=___;该反应能自发进行的原因是___。
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
反应B:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
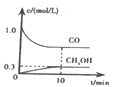
①一定温度下,在体积可变的恒压密闭容器中加入4 mol H2和一定量的CO发生反应A,开始时容器体积为2 L,CO和CH3OH(g)的浓度随时间变化如图1所示,10 min时达到平衡,则反应A的化学平衡常数为_______。(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应B已经达到平衡状态的是___(填序号)。
A. 容器内CO2的体积分数不再变化
B. 当CO2和H2转化率的比值不再变化
C. 当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H健
D. 容器内混合气体的平均相对分子质量达到34.5,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。

(1)上图所示氮循环中,属于氮的固定的有________(填字母序号)。
a. N2转化为氨态氮 b. 硝化过程 c. 反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一。
①氨气是生产氮肥的主要原料,工业合成氨的化学方程式为________。
②检验氨态氮肥中NH4+的实验方案是________。
(3)硝化过程中,含氮物质发生________(填“氧化”或“还原”)反应。
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol氮气时,转移的电子的物质的量为________ mol。
(5)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式分别说明利用土壤中的铁循环脱除水体中氨态氮和硝态氮的原理:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、SO2和Cl2是中学化学常见的气体,研究其性质和制备具有重要意义。回答下列问题:
(1)实验室中干燥氨气常用的干燥剂是___(填“碱石灰”或“五氧化二磷”)。
(2)某同学用干燥的圆底烧瓶收集满一瓶干燥氨气,进行喷泉实验并取得成功。说明氨气___(填“极易”或“不易”)溶于水;圆底烧瓶中溶液变红色,说明氨水呈___(填“酸性”或“碱性”)。
(3)某兴趣小组为验证SO2和Cl2的漂白性;设计了如下方案(尾气处理装置未画出)。

①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液呈___(填“红”或“无”)色;
②如图乙所示,将干燥的Cl2和SO2按体积比1:l混合通入石蕊溶液中,发现石蕊溶液变红,不褪色,用化学方程式解释之:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com