
【题目】下列说法正确的是 ( )
A. NH3比CH4更容易液化
B. 形成氢键能够使物质熔沸点升高
C. 稀有气体很稳定,是因为键能很大
D. 冰的密度比干冰的密度大
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。其中X、Y、Z都为气体,反应在t1min时到达平衡,如图所示,下列说法正确的是( )

A. 该反应的化学方程式是2X=3Y+Z
B. 已知1molX完全反应要吸收46kJ的热量,则至t1min时,该反应吸收的热量为36.8kJ·mol-1
C. 在此t1min时间内,用Y表示反应的平均速率v(Y)为0.6mol/(L·min)
D. 在相同状态下,反应前的压强是反应后的0.75倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在2003年,我国就己经成功发射“神舟五号”载人飞船,成为第三个把人送上太空的国家!发射航天飞船常用的高能燃料是肼(N2H4)。
(1)火箭推进器中盛有强还原剂液态肼和强氧化剂液态双氧水。已知肼分子中每个原子的最外层电子都达到了稳定结构,请写出肼的结构简式:________。由18O、16O、H、D原子组成的H2O2分子共有____种。
(2)肼-空气燃料电池是一种环保的碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时负极的电极反应式是________。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是__________。
(4)己知lg氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中lmol O=O键完全断裂时吸收热量496kJ,水蒸气中lmolH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构.为了验证凯库勒有关苯环的观点,甲同学设计了如图实验方案。

①按如图所示的装置图连接好各仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少最铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压預先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应方程式为_______,能证明凯库勒观点错误的实验现象是________。
(2)装置B的作用是________。
(3)C中烧瓶的容积为500mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,则实验结束时,进入烧瓶中的水的体积为_____ mL (空气的平均相对分子质量为29)。
(4)已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中含有______和_______两种官能团(写名称)。
②乳酸跟氢氧化钠溶液反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖。已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )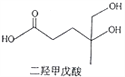
A. 能发生加成反应,不能发生取代反应
B. 一定条件下,能够发生水解反应
C. 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
D. 与乙醇发生酯化反应生成产物的分子式为C8H16O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知链烃A 的分子式为C6Hx,它与足量的溴水反应生成C6HxBr2,该生成物中含有两个甲基,则满足上述条件(不考虑立体异构)的链烃A的结构有
A. 5种 B. 6种 C. 7种 D. 9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。

①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的佛点关系如图乙所示,沸点:PH3<NH3,其原因是____________;沸点:PH3<AsH3<SbH3,其原因是______________________________________。

②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①磷化铝晶体中磷与铝微粒间的作用力为_____________________。
②图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为________。
③磷化铝晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为___________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com