
����Ŀ���������庬���϶��Ԫ��֮һ,�Ļ�������ҩ��������ũҩ����ȷ�����;�dz��㷺���ش��������⣺
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ____________________��
��2��P4S3������������,����ӽṹ��ͼ����ʾ��

�ٵ�һ�����ܣ���_____________��;�縺�ԣ���_____________��������>������<������
��P4S3��������ԭ�ӵ��ӻ��������Ϊ_____________��
��ÿ��P4S3�����к��µ��ӶԵ���ĿΪ______________��
��3��N��P��As��Sb���ǵ�VA���Ԫ�ء�
������Ԫ�ص��⻯��ķ���ϵ��ͼ����ʾ,�е㣺PH3<NH3,��ԭ����____________;�е�:PH3<AsH3<SbH3,��ԭ����______________________________________��

��ij�ִ��Ե������ľ����ṹ��ͼ����ʾ,�û�����Ļ�ѧʽΪ______��
��4�������۵�Ϊ2000��,���뾧��軥Ϊ�ȵ�����,���������ṹ��ͼ����ʾ��
�����������������������������Ϊ_____________________��
��ͼ��A���B���ԭ�����������ͼ����ʾ,��C���ԭ���������Ϊ________��
������������ܶ�Ϊ��g��cm-3,��NA��ʾ�����ӵ���������ֵ,��þ����о��������������ԭ��֮��ľ���Ϊ___________cm��
���𰸡� 1s22s22p53s23p3��[Ne]3s23p3 �� �� sp3 10 NH3���Ӽ���ڷ��Ӽ���� ��Է����������������Ӽ�������������ǿ Fe3N (����)���ۼ� (![]() ��
��![]() ��
��![]() )
) ![]()
��������(1)����15��Ԫ�أ���̬��ԭ�ӵĺ�������Ų�ʽΪ1s22s32p53s2p3���ʴ�Ϊ��1s22s32p53s2p3��
(2)����3pΪ������ṹ����Ϊ�ȶ�����һ�����ܣ��ף�����ķǽ����Ա���ǿ���縺�ԣ��ף��ʴ�Ϊ����������
��P4S3��������ԭ����2��Pԭ������������2���µ��Ӷԣ�����sp3���ʴ�Ϊ��sp3��
��ÿ��Pԭ����1���µ��Ӷԣ�ÿ��Sԭ����2���µ��Ӷԣ�ÿ��P4S3�����к��µ��ӶԵ���ĿΪ1��4+2��3=10���ʴ�Ϊ��10��
(3)�ٰ����Ӽ������������·е㣺PH3<NH3����Է����������������Ӽ�������������ǿ����˷е㣺 PH3<AsH3<SbH3���ʴ�Ϊ��NH3���Ӽ�����������Է����������������Ӽ�������������ǿ��
��Nԭ��λ�����ڣ���ĿΪ2��Feԭ��λ�ڶ��㡢���ĺ����ڣ���ĿΪ12��![]() +2��
+2��![]() +3=6������ѧʽ��дΪ��Fe3N���ʴ�Ϊ��Fe3N��
+3=6������ѧʽ��дΪ��Fe3N���ʴ�Ϊ��Fe3N��
(4)�������۵�Ϊ2000�棬����ԭ�Ӿ��壬���������������������������Ϊ���ۼ����ʴ�Ϊ�����ۼ���
�ڸ���A��(0,0,0)��B��(1�� ![]() ��
�� ![]() )��ԭ�����꣬��C��x������Ϊ
)��ԭ�����꣬��C��x������Ϊ![]() ��y������Ϊ
��y������Ϊ![]() ��z������Ϊ
��z������Ϊ![]() ��ԭ���������Ϊ(
��ԭ���������Ϊ(![]() ��
�� ![]() ��
�� ![]() )���ʴ�Ϊ��(
)���ʴ�Ϊ��(![]() ��
�� ![]() ��
�� ![]() )��
)��
����ԭ�Ӵ��ھ����ڲ��������к���4��Pԭ�ӣ���ԭ�Ӵ��ڶ�������ģ������к���Alԭ����ĿΪ6��![]() +8��
+8��![]() =4��Լ����������ȼȵû�ѧʽΪAlP����������Ϊ4��
=4��Լ����������ȼȵû�ѧʽΪAlP����������Ϊ4��![]() g������þ����ı߳�Ϊa cm����(a cm)3���� g/cm3=4��
g������þ����ı߳�Ϊa cm����(a cm)3���� g/cm3=4��![]() g����a=
g����a=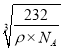 �����������Sԭ��֮�����Ϊ�����߳���
�����������Sԭ��֮�����Ϊ�����߳���![]() ����Sԭ��֮�����Ϊ
����Sԭ��֮�����Ϊ![]() ��
��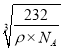 cm���ʴ�Ϊ��
cm���ʴ�Ϊ�� ![]() ��
��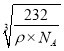 ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� ( )
A. NH3��CH4������Һ��
B. �γ�����ܹ�ʹ�����۷е�����
C. ϡ��������ȶ�������Ϊ���ܴܺ�
D. �����ܶȱȸɱ����ܶȴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ��У����ô���������ϸ��ƿ�������
A. ����� B. ����������Һ C. ���� D. ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.100mol/L��HCl��Һ�ζ�ijδ֪Ũ�ȵ�NaOH,�ü�����ָʾ�����ﵽ�ζ��յ�ʱ��Һ��ɫ�ı仯��
A.��ɫ���ɫB.��ɫ���ɫ
C.��ɫ���ɫD.��ɫ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������;�㷺,������ָʾ���ʹ������Ʊ���һ������ˮ�ܿ�[��Ҫ�ɷ�ΪCo2O3,������Fe2O3��Al2O3��MnO2��MgO��CaO��]��ȡ�����ܾ��壨CoC2O42H2O������������ͼ:
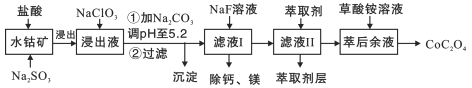
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ȫ������PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)���������м���Na2SO3�����ӷ���ʽΪ________________________
(2)NaClO3��������_________________��PH��5.2����������Ҫ�ɷ�Ϊ__________
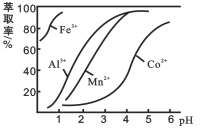
(3)��ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ2��ʾ����Һ���м�����ȡ����������___________________��ʹ����ȡ�����˵�pH��_______________
A. �ӽ�2.0 B.�ӽ�3.0 C.�ӽ�5.0
(4)���ơ�þ�ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪Ksp(MgF2)=7.35��1011��Ksp(CaF2)=1.05��1010.���������NaF��,������Һc(Mg2+)��c(Ca2+)=________________.
(5)��֪���ܷ����к�Co2O3��������Ϊa%,��ȡmkg�ú��ܷ��ϰ����������̣�������������Ƶò����ܾ��������Ϊ_________________g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����������ֵ���ֱ�ӷ�Ӧ���ɣ������������Ba(OH)2��Һ���а�ɫ�����������������ʷ���������������
A. AlCl3 B. FeCl3 C. SO2 D. SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ��һ�����ʻ��õĽ�������ش��������⣺
(1)����ͬѧͨ��ʵ��̽��Mg�ܷ���CO2������ȼ�գ���þ���ڿ����е�ȼ��Ѹ�ٲ���ʢ��CO2����ļ���ƿ�У��۲쵽þ������ȼ�գ�ƿ�ڱڳ��ֺ�ɫ�������������д��Mg��CO2��ȼ�յĻ�ѧ����ʽ��__________
(2)����ͬѧ���ݼ���ʵ�飬�Ʋ�MgҲ����NO2��ȼ�գ����ܲ���ΪMgO ��Mg3N2����N2����ͨ����ͼ����װ�ü�ҩƷ����֤��Ӧ����г�װ��ʡ�ԣ������������ظ�ʹ�ã���
��֪��a. Mg3N2��ˮǿ��ˮ�⡣
b. NO2�����ܱ�NaOH���ա�
c.25��ʱ�����볣����CH3COOH��Ka=1.8��10-5 NH3��H2O��Ka=1.8��10-5
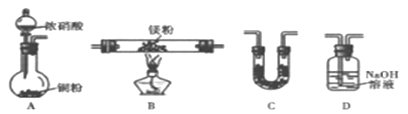
�ش��������⣺
������ͬѧʵ��װ�����ӵ���ȷ˳��ΪA��__________����װ����ĸ����װ��C��ʢ�ŵ��Լ���________��
�ڵ�ʵ������г���_________����ʱ�����ܿ�ʼ���ȣ�ȷ����������N2���ɵ�ʵ������Ϊ_________��
��װ��D�������������ʵ�����ȵ����Σ������ӷ���ʽΪ___________��
(3)���ʵ��֤����
�ٲ����д���Mg3N2��__________________��
��Mg(OH)2��NH4+ֱ�ӷ�Ӧ���ܽ⣺_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2��0molPCl3��1��0molCl2�������������ܱ������У���һ�������·���������ӦPCl3��g��+Cl2��g��![]() PCl5��g������ƽ��ʱPCl5Ϊ0.4mol�������ʱ����1��0molPCl3��0.5molCl2������ͬ�¶����ٴ�ƽ��ʱPCl5���ʵ�����
PCl5��g������ƽ��ʱPCl5Ϊ0.4mol�������ʱ����1��0molPCl3��0.5molCl2������ͬ�¶����ٴ�ƽ��ʱPCl5���ʵ�����
A. 0.4 mol B. 0.2 mol
C. ��0.2 mol D. ����0.2 mol��0.4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ��ҽҩ�м��壬��ṹ��ʽ��ͼ��ʾ������ �йػ�����X��˵����ȷ����
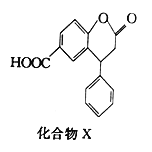
A. ������������ˮ�⣬ˮ�����ֻ��һ�� B. �����뱥��Na2CO3��Һ��Ӧ
C. ��������������һ������ͬһƽ�� D. 1 mol������X�������2 mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com