
【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO2、MgO、CaO等]制取草酸钴晶体(CoC2O42H2O)工艺流程如图:
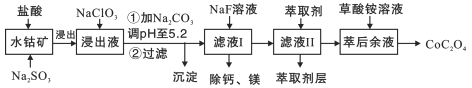
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的离子方程式为________________________
(2)NaClO3的作用是_________________调PH至5.2,沉淀的主要成分为__________
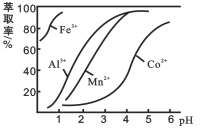
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示。滤液Ⅱ中加入萃取剂的作用是___________________;使用萃取剂适宜的pH是_______________
A. 接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×1011、Ksp(CaF2)=1.05×1010.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=________________.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为_________________g
【答案】 2Co3++SO32-+ H2O= 2Co2++SO42-+2H+ 将 Fe2+氧化为 Fe3+ Al(OH)3、Fe(OH)3 除去Mn2+ B 0.7 1830ma/83 或 16.6ma
【解析】(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,其中的一个反应离子方程式为2Co3++SO32-+ H2O= 2Co2++SO42-+2H+ ;
(2)NaClO3的作用是:将浸出液中Fe2+氧化为Fe3+,
故答案为:将浸出液中Fe2+氧化为Fe3+;加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀,沉淀的主要成分为Al(OH)3、Fe(OH)3 ;
(3)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn2+的萃取率增大很多,而pH=4时,Co2+的萃取率比较大,故pH=3时最佳,;
(4)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=![]() =0.7;
=0.7;
(5)mkg该含钴废料中含Co2O3的物质的量为![]() =
=![]() mol,根据原子守恒则草酸钴晶体的物质的量为
mol,根据原子守恒则草酸钴晶体的物质的量为![]() mol×2=
mol×2=![]() mol,理论上最多能制得草酸钴晶体的质量为
mol,理论上最多能制得草酸钴晶体的质量为![]() mol×183g/mol=16.6mag。
mol×183g/mol=16.6mag。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X 、Y 、Z 、M 、N 、Q皆为1~20 号元素,其原子半径与主要化合价的关系如图所示。下列说法不正确的是( )

A. 1 mol 的QX2与足量X2Y 反应可产生2 md X2
B. 简单离子半径:Y 2—>N+>M 3+
C. 由X、Y、Z 三种元素形成的化合物只能是共价化合物
D. Z 、N 、M 的最高价氧化物的水化物两两间都能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题
(1)有机化合物B中的含氧官能团为__________和__________(填名称)。
(2)上述反应中,过程②属于__________反应,过程④属于__________反应。
(3)若过程①发生的是取代反应,且另一种产物有HBr,写出由A到B发生反应的化学方程式__________________。
(4)非诺洛芬的一种同分异构体满足下列条件:
Ⅰ.能与NaHCO3反应放出CO2,能与 FeCl3溶液发生显色反应。
Ⅱ.分子中有6 种不同化学环境的氢,且分子中含有两个苯环。
写出符合条件的一种同分异构体的结构简式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为
A. 3∶2 B. 2∶1 C. 3∶4 D. 4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。

①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的佛点关系如图乙所示,沸点:PH3<NH3,其原因是____________;沸点:PH3<AsH3<SbH3,其原因是______________________________________。

②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①磷化铝晶体中磷与铝微粒间的作用力为_____________________。
②图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为________。
③磷化铝晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为___________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的甲、乙两个装置,均挤压胶头滴管,一段时间后两装置中的气球都明显胀大(忽略液体体积气球体积的影响),则滴管和烧瓶中所有试剂可能是( )

选项 | 甲 | 乙 | ||
滴管 | 烧瓶 | 滴管 | 烧瓶 | |
A | 浓硫酸 | Fe | NaOH溶液 | SO2气休 |
B | 双氧水 | MnO2 | AgNO3溶液 | HCl气体 |
C | 浓硝酸 | Al | H2O | 氨气 |
D | 氨水 | CaO | 稀盐酸 | NaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系
①2-甲基丁烷和异戊烷_____________________________。
②1-已烯和环已烷_______________________________。
(2)支链只有一个乙基且相对分子质量最小的烷烃的结构简式____________________。
(3)写出乙醛溶液与足量的银氨溶液共热的离子方程式:_____________________________ 。
(4)写出1,3-丁二烯与溴单质发生1,4-加成的反应方程式__________________。
(5)写出由乙烯制乙醇的化学方程式__________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com