
【题目】下列物质中不属于有机物的是
A.CO(NH2)2B.CCl4C.KHCO3D.CH3CH2OH
科目:高中化学 来源: 题型:
【题目】有一种星际分子,其分子结构模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,不同花纹的球表示不同的原子)。

对该物质判断正确的是 ( )
A.①处的化学键是碳碳双键
B.②处的化学键是碳碳三键
C.③处的原子可能是氯原子或氟原子
D.②处的化学键是碳碳单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=____________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母)。
a.升高温度 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q__________(填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
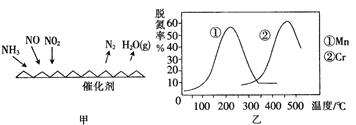
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳, 若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应温度分别为___________________________。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。已知常温下Ka1(H2SO3)=1.8×10-2 , Ka2(H2SO3)=6.0×10-9。常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO2、MgO、CaO等]制取草酸钴晶体(CoC2O42H2O)工艺流程如图:
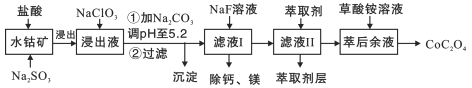
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的离子方程式为________________________
(2)NaClO3的作用是_________________调PH至5.2,沉淀的主要成分为__________
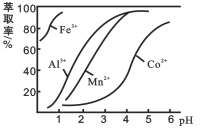
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示。滤液Ⅱ中加入萃取剂的作用是___________________;使用萃取剂适宜的pH是_______________
A. 接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×1011、Ksp(CaF2)=1.05×1010.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=________________.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为_________________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向下图装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,加热后乂恢复红色。据此判断气体X和洗气瓶内溶液Y分别可能是
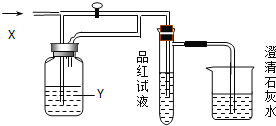
A | B | C | D | |
X | SO2 | H2S | CO2 | Cl2 |
Y | 饱和NaHCO3 | 浓硫酸 | Na2SO3 | NaHCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种性质活泼的金属,请回答下列问题:
(1)甲组同学通过实验探究Mg能否在CO2气体中燃烧,将镁条在空气中点燃后迅速插入盛有CO2气体的集气瓶中,观察到镁条剧烈燃烧,瓶内壁出现黑色固体颗粒等现象。写出Mg在CO2中燃烧的化学方程式:__________
(2)乙组同学根据甲组实验,推测Mg也能在NO2中燃烧,可能产物为MgO 、Mg3N2、和N2。请通过下图所给装置及药品来验证反应产物(夹持装置省略,部分仪器可重复使用)。
已知:a. Mg3N2遇水强烈水解。
b. NO2气体能被NaOH吸收。
c.25℃时,电离常数:CH3COOH的Ka=1.8×10-5 NH3·H2O的Ka=1.8×10-5
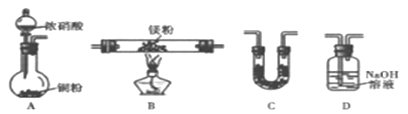
回答下列问题:
①乙组同学实验装置连接的正确顺序为A→__________(填装置字母);装置C中盛放的试剂是________。
②当实验过程中出现_________现象时,才能开始加热,确定产物中有N2生成的实验现象为_________。
③装置D中生成两种物质的量相等的钠盐,其离子方程式为___________。
(3)设计实验证明:
①产物中存在Mg3N2:__________________。
②Mg(OH)2与NH4+直接反应而溶解:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵在加热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
A. 1:3 B. 2:3 C. 1:1 D. 3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com