
【题目】霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=____________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母)。
a.升高温度 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q__________(填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
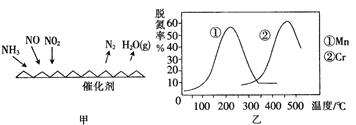
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳, 若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应温度分别为___________________________。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。已知常温下Ka1(H2SO3)=1.8×10-2 , Ka2(H2SO3)=6.0×10-9。常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=____________。
【答案】 0.042 mol·L-1·min-1 9/16 bc < NO、NO2 2NH3(g)+NO(g)+NO2(g) ===2N2 (g)+ 3H2O(g) △H = -2Q kJ·mol-1 Mn、200℃左右均可(说明:Cr和Mn最大脱氮率相差不大,但是Cr需要的温度高,为使效益最大化,因此使用Mn更经济); 4.2×10-9
【解析】(1)①0~10min内,NO的平均反应速率v(NO)=![]() =0.042molL-1min-1;C(s)+2NO(g)N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=
=0.042molL-1min-1;C(s)+2NO(g)N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=![]() =
=![]() ;
;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)N2(g)+CO2(g),依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算K=![]() ,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;a.升高温度,平衡常数改变,平衡移动,故a错误;b.通入一定量的NO,新平衡状态下物质平衡浓度增大,故b正确;c.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故c正确;d.加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,故d错误;故答案为bc;
,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;a.升高温度,平衡常数改变,平衡移动,故a错误;b.通入一定量的NO,新平衡状态下物质平衡浓度增大,故b正确;c.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故c正确;d.加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,故d错误;故答案为bc;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为5:3:3,氮气和二氧化碳难度之比始终为1:1,所以5:3>4:3,说明平衡向逆反应方向移动,说明逆反应是吸热反应,则正反应是放热反应,故选<;
(2)①由图甲可知SCR技术中NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2;脱氮效果最佳时c(NO2):c(NO)=1:1,因此反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2QkJmol-1;
②根据图乙知Mn催化剂时,在200℃左右脱氮率最高,Cr作催化剂,500℃左右脱氮率最高,但二者的最高脱氮率差不多,使用Mn作催化剂需要的温度低,更经济,因此使用的最佳的催化剂和相应的温度分别为Mn、200℃左右;
(3)由Ka2(H2SO3)=6.0×10-9可知SO32-+H2OHSO3-+OH-的水解Kh=![]() =1.67×10-4,常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,可知c(SO32-)=
=1.67×10-4,常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,可知c(SO32-)=![]() =6×10-5,又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。
=6×10-5,又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】锰锂电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
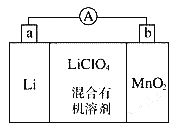
(1)外电路的电流方向是由____极流向___极(填字母)
(2)电池正极反应式___________。
(3)MnO2可与KOH和KClO3在高温下反应,生成反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化铜(Ⅱ)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:

(1)铜元素位于周期表中第___族___区,基态Cu2+的核外电子排布式为______________。
(2)与NH4+互为等电子体的阴离子为__________________。
(3)MIm中碳原子杂化轨道类型为____________;1molMIm中含![]() 键数目为________ mol。
键数目为________ mol。
(4)一种铜的溴化物晶胞结构如图所示。
有关说法正确的是____________(填序号)。
a.该化合物的化学式为CuBr2 b.铜的配位数为8
c.与每个Br紧邻的Br有12个
d.由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(![]() ,
,![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X 、Y 、Z 、M 、N 、Q皆为1~20 号元素,其原子半径与主要化合价的关系如图所示。下列说法不正确的是( )

A. 1 mol 的QX2与足量X2Y 反应可产生2 md X2
B. 简单离子半径:Y 2—>N+>M 3+
C. 由X、Y、Z 三种元素形成的化合物只能是共价化合物
D. Z 、N 、M 的最高价氧化物的水化物两两间都能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述不正确的是: ( )
A. 5.8g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.02NA
B. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
C. 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2
D. 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题
(1)有机化合物B中的含氧官能团为__________和__________(填名称)。
(2)上述反应中,过程②属于__________反应,过程④属于__________反应。
(3)若过程①发生的是取代反应,且另一种产物有HBr,写出由A到B发生反应的化学方程式__________________。
(4)非诺洛芬的一种同分异构体满足下列条件:
Ⅰ.能与NaHCO3反应放出CO2,能与 FeCl3溶液发生显色反应。
Ⅱ.分子中有6 种不同化学环境的氢,且分子中含有两个苯环。
写出符合条件的一种同分异构体的结构简式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为
A. 3∶2 B. 2∶1 C. 3∶4 D. 4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种基态原子的核外电子排布式中,正确的是( )。
A. 1s22s12p2 B. 1s22s22p33s1
C. 1s22s22p63s14s1 D. 1s22s22p63s23p64s1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com