
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgCl)数量级为1010。下列叙述正确的是
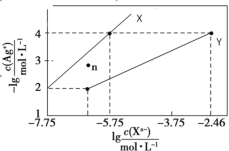
A.图中X线代表的Ag2C2O4
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4+2Cl=2AgCl+ C2O42-的平衡常数为100.71
【答案】C
【解析】
从X线上的点(-5.75,4)可知,当c(Xn-)=10-5.75时,c(Ag+)=10-4。从Y线上的点(-2.46,4)可知,当c(Xn-)=10-2.46时,c(Ag+)=10-4。
A.Ksp(AgCl)数量级为1010,X线上的点(-5.75,4),c(Xn-)=10-5.75时,c(Ag+)=10-4,两种离子浓度乘积为10-9.75,数量级为1010,所以X线代表的是AgCl,故A错误;
B.X线代表的是AgCl,则Y线代表的就是Ag2C2O4,n点在Y线的上方,n点溶液中的离子浓度小于Ag2C2O4的饱和溶液中的离子浓度,所以n点表示的是Ag2C2O4的不饱和溶液,故B错误;
C.从图像可以看出,当c(Cl)=c(C2O42-)时,滴入硝酸银溶液,生成AgCl沉淀需要的c(Ag+)小,所以先生成AgCl沉淀,故C正确;
D.Y线代表的是Ag2C2O4,用Y线上的点(-2.46,4)可求出Ag2C2O4的Ksp=c2(Ag+)c(C2O42-)=10-10.46。Ag2C2O4+2Cl=2AgCl+ C2O42-的平衡常数K=![]() =
=![]() =
=![]() =
=![]() =109.04,故D错误;
=109.04,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
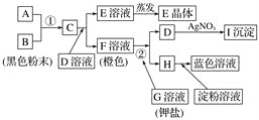
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (如图)是一种重要的材料中间体,下列有关化合物
(如图)是一种重要的材料中间体,下列有关化合物![]() 的说法中正确的是
的说法中正确的是
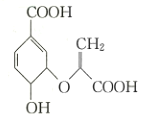
A.分子中含有三种官能团
B.可与乙醇、乙酸反应
C.所有碳原子一定处于同一平面
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
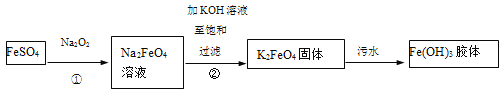
以下说法不正确的是
A.①中一定发生了氧化还原反应
B.污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点
C.另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H+ +H2O
D.K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在研究物质性质及物质转化方面具有重要的的价值。
(1)化合价是学习氧化还原反应的基础。在括号中写出以下几种物质中划线元素的化合价。
NaI(____) ClO3-(____) K2MnO4 (___) Br2(___)
(2)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生黄绿色气体,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。

A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2其原理如图所示,正确的是( )
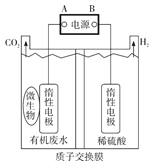
A. 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
B. 电源A极为负极
C. 通电后,若有22.4LH2生成,则转移2mol电子
D. 与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com