
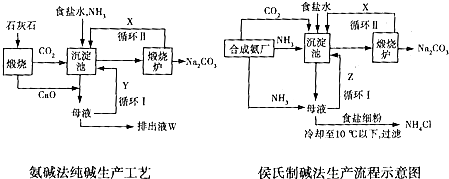
分析 (1)依据生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙与铵盐反应生成的氨气;
(3)相比氨碱法,侯氏制碱法有氯化钠的利用率加大,副产品有氮肥;
(4)联碱法母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;Z中除了溶解的氨气、食盐外,其它溶质还有氯化铵、碳酸钠;氨碱法排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙,氯化钠;NH4HCO3受热分解;
(5)向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度;加入食盐细粉目的是提高Cl-的浓度,使氯化氨析出;
(6)根据生产成本分析.
解答 解:(1)依据流程图分析可知,生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
故答案为;NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用;
故答案为:CO2; NH3;
(3)A.相比氨碱法,侯氏制碱法中氯化钠的利用率提高,A正确;
B.氨碱法,侯氏制碱法都需要氨气,B错误;
C.氨碱法,侯氏制碱法生产过程中都有部分反应产物可作为原料循环使用,C错误;
D.侯氏制碱法副产品是一种氮肥,原料利用充分,D正确;
E.两种方法中煅烧都需要加热,E错误;
故答案为:AD;
(4)依据两个过程中的物质发生的反应分析,联碱法母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;Z中除了溶解的氨气、食盐外,其它溶质还有氯化铵、碳酸钠;氨碱法排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙,氯化钠;NH4HCO3受热分解为氨气、二氧化碳均为气体;
故答案为:CaCl2;Na2CO3; NH4HCO3受热分解无残留;
(5)a.常温时氯化铵的溶解度比氯化钠大,a错误;
b.通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,b正确;
c.加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,c错误;
d.氯化铵的溶解度受温度影响比氯化钠大,d正确;
故答案为:bd;
(6)氢氧化钠制备碳酸钠的成本过高,故不可以;
故答案为:不可以,用氢氧化钠制备碳酸钠成本过高,得不偿失.
点评 本题考查了联碱法和氨碱法生产流程的原理比较和物质分析判断,纯碱制备的条件应用和产物的提纯析出,反应过程中反应的原理分析和物质来源是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2O与Na2O2都是碱性氧化物 | |
| B. | 生石灰能与水反应,可用来干燥氨气 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 氯化铝是一种离子型电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于32.8% | B. | 小于32.8% | C. | 等于32.8% | D. | 约等于32.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
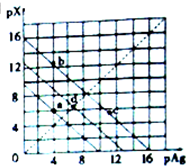 某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )| A. | 由a点可知该温度下Ksp(AgCl)=l0-10 | |
| B. | 加入AgNO3可使溶液由b点变到c点 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | 坐标点(14,8)形成的溶液是AgI的不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
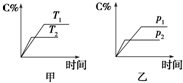 可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题:
可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)═2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为-a-b-c | |
| B. | 若2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 如图可表示水分解过程中的能量变化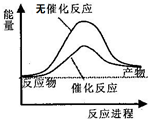 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 50g | 20g | 20g | 10g | 5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com